変化する分子構造を凍結して見せる。クライオ電子顕微鏡が生命の神秘を解き明かす

INTERVIEW 07
大阪大学大学院生命機能研究科
難波 啓一 教授
生物の体を構成し、思考や動作の働きの元となるタンパク質。その優れたメカニズムに魅せられた大阪大学の難波啓一教授は、立体構造からその秘密を解き明かそうという挑戦を続けている。
構造から機能を理解する
人間の体内には約10万種類のタンパク質がある。体の組織をつくるもの、酵素として代謝を担うもの、細胞膜上で栄養素などをやりとりするもの、抗体として外敵を攻撃するものなど、それぞれに役割があり、それはまさに生命活動そのものといえる。 「タンパク質はいわば生体内で働く"ナノマシン"。そんな小さな"機械"がどんな役割を持って、どうやって動いているのか、興味は尽きません」と、語るのは大阪大学生命機能研究科プロトニックナノマシン研究室の難波啓一教授。タンパク質の構造から働きを解明しようという研究に40年以上携わってきた。
タンパク質はアミノ酸が数百から数千個連なった高分子だ。一部特殊なものを除き、その材料となるアミノ酸は20種類しかない。それらがどう組み合わさるかで10万もの種類が出現するのだ。数千個が連なったものというと、鎖のような姿を想像するかもしれない。たしかに一連なりになっているという点では同じだが、鎖と決定的に違うのは、タンパク質はそれぞれ固有の立体構造を持つところだ。長いアミノ酸の鎖が複雑に折りたたまれるようにしてできており、同じタンパク質であれば、どれをとってもまったく同じところで曲がり、その角度も同じになる。ただし、その折れ方がときに変わることがある。興味深いのは、同じ分子構造でも立体構造が違うだけでまったく違う性質を持つようになることだ。例えば、2000年代の初頭に大きな問題となり、飲食業界をパニックに陥れたBSEの原因はウイルスでも薬剤でもなく、プリオンというタンパク質だとされている。このプリオン、驚いたことに人間や牛の脳に、もともと存在している。BSEの原因となった異常プリオンは、立体構造が一部違うだけなのだ。つまり、タンパク質の働きを知るには、分析装置でその分子構造を知るだけでなく、何とかしてその立体構造を観察しなければならないのだ。
精緻な生体分子モーター
教授は早くから生体分子の立体構造に着目し、研究を続けてきた。中でも興味を引かれたのは分子モーターと呼ばれる一群のタンパク質だ。あたかもモーターのように回転運動をしたり直線運動するところからこの名前がつけられた。ヒトの筋肉の場合、アクチンやミオシンといったタンパク質が組み合わさって筋原繊維を形成しており、これが直線運動することで筋収縮を起こす。よりモーターらしいのは、バクテリアが持つ細長いしっぽのような形状をしたべん毛を動かしている分子モーターだろう。大腸菌やサルモネラ菌は数本のべん毛を持ち、移動するときはそれらを一筋に束ねて、スクリューのように回転させて推進力を得ている。しかし、それらの構造は長らく不明のままだった。
その不思議にとりつかれた教授は、立体構造を解明すべく研究を重ねた。べん毛モーターは"モーター"の名の通り、リングや軸受け、回転子など30種類のタンパク質"製"の部品からなり、一般の電気モーターと非常に似通った構造を持っていた。筋繊維はアクチン繊維とミオシン繊維の超精密で膨大な繰り返し構造でできている。モーターは、人間が生み出した最大の発明のひとつとも言われるが、とんでもない思い上がりだったというわけだ。
モーターとして運動するからには、どこからかエネルギーを調達してこなければならない。べん毛モーターは細胞膜を貫通する固定子のチャネルを通した水素イオンの流れ、筋繊維はアクトミオシンのATP加水分解であるとわかっていたが、それだけではエネルギー効率の高さの説明ができなかった。熱ゆらぎによるブラウン運動のエネルギーが使われているのではとの考えもあったが、その仕組みは不明であった。熱のもとは原子や分子の揺らぎのエネルギーで、物体を原子レベルまで拡大して見れば、でたらめな向きやスピードで動き回る原子や分子が観察できるだろう。
熱による分子や原子のランダムな動きでは、分子モーターとても一方向の推進力を作り出せないはずだ。ところが実際には一方向に動く。つまり、でたらめな運動が整流されるしくみがあるようなのだ。
最近、教授はその正体に大きく近づいた。筋繊維のアクトミオシンには一方向にのみはずれやすく、他方向にははずれにくくなるラチェットのような構造があることを発見したのだ。タンパク質分子が立体構造を変化させながら、この巧みな動力システムを作り上げていたのだ。
クライオというフロンティア

難波教授の研究室に導入された日本電子製クライオ電子顕微鏡 "CRYO ARM™"
こうした発見ができたのもタンパク質の立体構造をしかと見ることができたからだ。その目として長く主流だったのはX線結晶構造解析と呼ばれる手法。これはタンパク質を結晶化させ、X線を当てて、その回折反射強度を測定する。1950年代から使われてきた手法で立体構造の判明しているタンパク質の90%はこの方法による。
しかし大きな弱点がある。それは、結晶化が前提となっていることだ。そもそも結晶化させることが難しい。また、結晶化させるということは一番安定な立体構造に固定してしまうということだ。分子モーターがその機能を発揮するときは構造が大きく変化するが、結晶化できるのは安定な形だけ。つまり、変化する立体構造は見えないのだ。
そこで、注目を集めているのがクライオ電子顕微鏡だ。これは-160〜-270度の極低温で試料を凍らせたまま観察できる「クライオステージ」という試料ステージを持つ電子顕微鏡だ。タンパク質分子一個一個を液体エタンで瞬間的に凍らせ、"生きた"状態を氷の中に閉じ込めた試料を作製。クライオ電子顕微鏡でさまざまな方向から投影像を観察することで、タンパク質が働く瞬間の構造を立体的に捉えられるというわけだ。凍らせるだけなので、結晶化条件を探る必要もない。
難波教授は20年以上も前からクライオ電子顕微鏡に着目して、解析手法の開発を進めてきた。筋繊維アクトミオシンの動作メカニズムを明らかにしたのもクライオ電子顕微鏡による成果だ。べん毛モーターの詳細な立体構造も見えてきている。それは教授の宿願でもあった。
「タンパク質のような小さなものの働きがどうして目に見える筋肉の動きになるのか。私が研究を始めた理由がまさにそれでした。学生時代の宿題に半分くらい答えられた気がしますね」。
世界最高を目指した一台

別室からクライオ電子顕微鏡を操作する加藤助教(左)と難波教授
クライオ電子顕微鏡は長くX線構造解析の後塵を拝してきた。分解能が十分ではなかったことがその原因だ。電子顕微鏡は強い電子線を試料に当て、試料を透過する電子線を受け取り、その陰影によって試料の形を描きだす。だが、強い電子線を当てると、生体分子は構造が破壊されてしまうため、出力を絞らざるをえなかったのだ。ちょうど暗い部屋を豆電球で照らしても、ぼうっとしか見えないと同じ理屈だ。
しかし、その課題も長年の技術開発によって克服されつつある。ハードウェアの面ではカメラが長足の進歩を遂げた。CCDカメラでは電子線をいったん光に変換しそれを受光する。その過程でノイズが増幅し、検出性能を上げられなかった。だが、電子線を直接受けられるCMOSカメラが登場し、感度も解像度も向上し、高速フレーム観察により像ブレ補正までできるようになった。こうして像質が劇的に上がった。
ソフトウェアの面では、画像処理ソフトの進歩が目覚ましい。様々な方向から撮影した何十万枚というタンパク質の像から同じ方向の投影像を探し出し、位置と向きを揃えて重ね合わせて像を鮮明にしていく。コンピュータの処理速度が上がったことで、こうした複雑な情報処理を研究室レベルでできるようになったのだ。
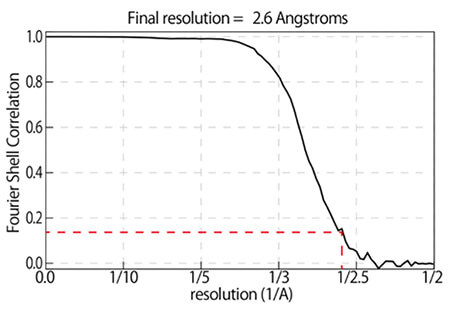
今回、難波教授の研究室に導入されたCRYO ARM™は、教授の「世界最高を」という要請を受けて開発されたもので、構造解析結果が2.0オングストローム(1オングストロームは0.1nm)を越えることを目標に設計。標準的なX線結晶解析を超える分解能を目指している。さらに試料も複数セットして自動で入れ替えできるようになり、利便性も向上。画像収集や解析の時間も大幅に短縮し、5、6年前には1年もかかっていた解析が、1週間で終えられるまでになった。
ブレークスルーは間もなく
「あと5年もあれば、タンパク質だけでなく、脂質や核酸を含むすべての生体分子複合体の立体構造が見えるようになるでしょう」と、教授は期待をのぞかせる。
特に応用に向けて解析が期待されているのは、細胞表面にある膜たんぱく質の構造だ。医薬分子が体に作用する際のターゲットであり、その構造解析から作用の機序を明らかにできる。そうすれば治療成果を飛躍的に引き上げ、かつ副作用のない薬をつくれるようになることだろう。
いずれは生体分子モーターを産業応用しようという動きも出てくるかもしれない。電源も不要で、周囲の熱を主なエネルギー源にして動作する超省エネルギーの機械。それは、人類が有史以来培った機械の常識を覆すことになる。
実現までの道のりはまだまだ長い。だが、その足音は耳に届き始めている。
β-galactosidase 2.6 Å resolution CRYO ARM™
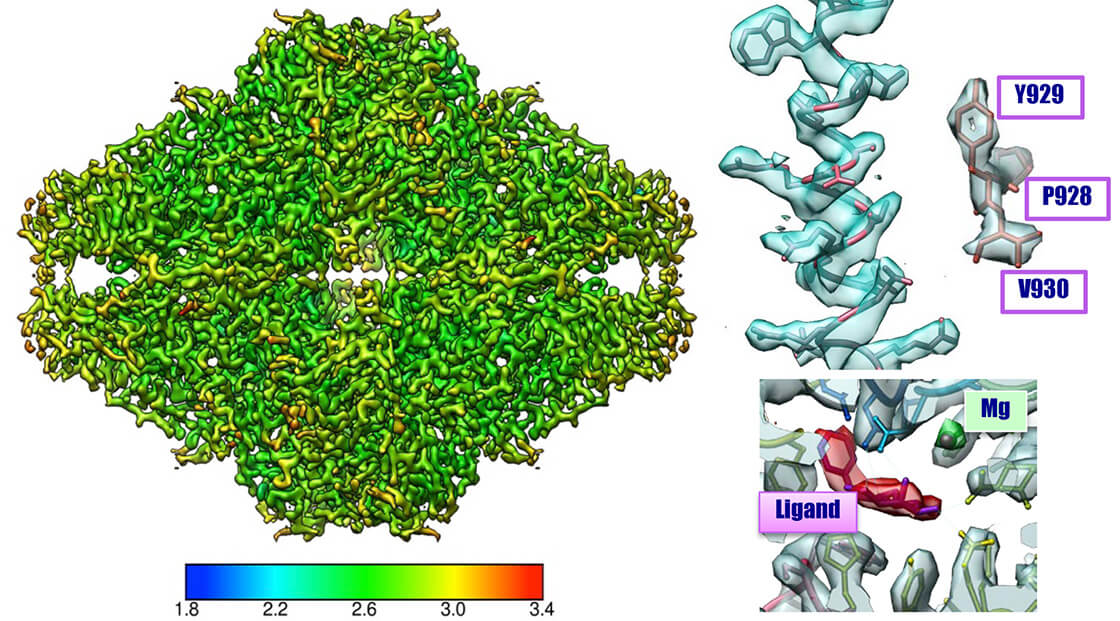
Sample:
β-galactosidase with PETGMicroscope:
CRYO ARM™ (Schottky 200 kV) / K2 summitNumber of Images:
2,500 over 3 days by JADASImage pixel size:
0.8 Å/pixelNumber of particle images:
350,000(Initial pickup), 88,564 (for final 3D reconstruction)Software:
Motioncor2, Gctf, Gautomatch, Relion2.0Total dose:
70 e-/Å2 (70 frames (0.2 sec/frames x 14 sec)
Data: courtesy by Dr. T. Kato and Dr. K. Namba, Osaka University, August 2017

難波 啓一(なんば けいいち)
大阪大学大学院生命機能研究科教授
大阪大学大学院基礎工学研究科博士後期課程修了後、日本学術振興会奨励研究員、米国大学での博士研究員、新技術事業団 (現・科学技術振興機構) グループリーダー等を経て、1992年より松下電器産業株式会社 国際研究所リサーチディレクター。2002年より現職。専門は分子モーターなどの生体超分子の構造と機能の解析。生物物理学。
掲載:2017年9月
