生物学の研究における新発見を目指して より重要なデータを探索する生物学電子顕微鏡法

INTERVIEW 08
ロンドン大学キングスカレッジ
教授 Roland Fleck
細胞・分子の構造を理解することは、生物医学研究において極めて重要である。イギリス: King’s College London, CUI(Centre for Ultrastructural Imaging)のディレクターであるRoland Fleck教授は日本電子とのパートナーシップのもと、JSM-7800FPRIME走査電子顕微鏡(SEM)、JEM-F200透過電子顕微鏡(TEM)などを使い生物などの構造の高分解能観察に全力を傾けてきた。CUIの中に日本電子との共同で設けられたJCAT (JEOL Centre for Advanced Technology)では、通常の室温での電子顕微鏡法及び、極低温でのクライオ電子顕微鏡法を駆使して研究が行われている。
なぜ複雑な生物学的プロセスを理解することが重要なのか
ロンドン大学キングスカレッジのCUI(Centre for Ultrastructural Imaging)を率いるFleck教授はTEMとSEMを使った先端イメージング技術を用いて、複雑な生物学的プロセスの理解を深めることに精力を注いでいる。「生物学的プロセス」とは多岐にわたる生物学的現象のことであり、ゲノム形成、シグナル伝達、細胞周期の進行、その他の複雑なシステムなどを含む。
人間の体には異なる機能に特化した様々な器官がある。目はものを見て、足で歩く。個々の機能(見たり、歩いたり、つかんだり)はあらゆる空間的スケールで起こる。目では、レンズと視細胞がそれぞれ視覚に貢献し、個々の視細胞の異なる部分に集合した様々な分子が各々の任務を遂行する(ある分子は光を検出し、ある分子は脳に光を検出したことを知らせる)。ただ、分子の働きを観察して調べるためには、約100万倍もの倍率が必要である。これは通常の光学顕微鏡では実現不可能で、そのためには、より波長の短い電子ビームを使う顕微鏡が必要である。しかし、電子顕微鏡で観察できる対象は、人間の髪の毛の千分の一の厚さに相当するきわめて薄い生体組織試料に限られる。一つの細胞全体を見るには、この薄い切片試料を何百枚も観察しなければならない。
細胞や生体組織の観察にはまず、電子顕微鏡に適した試料を作製しなければならない。どのように試料作製を行うかは多くの異なる分野の専門知識を必要とする。さらに試料作製手順が試料に与える物理化学的な効果や影響を良く理解し、それを最適化する研究も必要である。Fleck教授はより高品質の情報を生物試料から得るために、独自の研究を通じて試料作製法の改善を追求している。「このためにも、日本電子との協力関係は貴重です」とFleck教授は語る。
生体組織のクライオ試料作製
生体組織は細胞の集団で構成される。例えば、心臓という「器官」は、心筋、血管、神経などの生体組織で構成され、ある一定の秩序のもとに結合したこれらの組織により様々な役割を果たす。したがって、生体組織の機能を理解するにはその形態や構造を明らかにすることが必須となる。
クライオ(極低温)電子顕微鏡法は、このような生体組織の「生きた」状態を凍結し低温で保つことにより生体組織の観察を可能とする。凍結試料は極低温で冷却されたまま、電子顕微鏡に取り付けられた「クライオ」ステージ上で観察される。試料の凍結時に結晶性の氷の生成を防ぐこと(試料を非晶質の氷に包埋すること)が、クライオ電子顕微鏡法における像の質と分解能を向上させる要諦である。氷結晶の生成により、試料の本来の構造にダメージが起こるからである。非晶質の氷に包埋することにより、生体組織の「生きた」状態の構造を観察することができ、化学固定や脱水処理により生じるアーティファクトや細胞内での氷の生成に起因する超微細構造の崩壊が避けられる。
Fleck教授は多くのクライオ技法を駆使し、凍結の際に氷結晶が作られるのを防止している。液体エタンやプロパンなどの中間冷却剤による急速な冷却は、断熱性の蒸気の膜が冷却速度を遅くしてしまうLeidensfrost効果と呼ばれる現象を防ぎ、少ないボリュームの試料を非晶質の氷に包埋することを可能にする。この手法は、2017年にノーベル化学賞(クライオ電子顕微鏡法)を受賞した一人であるJacques Dubochetにより確立され、水溶液中の生体分子のように孤立分散した小さな粒子を非晶質の氷に包埋して、単粒子解析用の薄膜TEM試料にすることができる。 細胞全体や生体組織から成る厚い試料に対しては、高圧(高い圧力の)冷凍機が使われる。高圧凍結法は水の物理的性質に基づいている。凍結時に試料に掛けられる2.1×108 Pa (2,100 bars)の圧力は物理的な凍結保護剤として機能する。高圧は水の結晶化による体積膨張を抑え、氷結晶の生成速度を鈍化させ、非晶質氷の形成に必要な臨界冷却速度を減少させる(10,000°C.s-1)。非晶質氷に包埋された生体組織のブロック試料は凍結置換され、クライオ温度(極低温)で切片にされるか或いは割断され、クライオSEMで直接観察するか、TEM観察用のレプリカを作りTEMで観察する。Fleck教授はこのような先端技法を駆使して様々な疑問の解明に取り組んでいる。例えば、高圧凍結法は今や神経細胞の電気的・光学的刺激法と統合され、刺激-固定の時間的相関を高いレベルで実現することにより、生物の脳の中でどのような情報が神経細胞(ニューロン)同士の間で伝達されるかを研究するのに役立っている。
光学顕微鏡法では、生体細胞中のコンパートメント(区画のように仕切られた部位)に閉じ込められたタンパク質を表示するのに蛍光タグが使われる。しかし、この手法では細胞機能の基盤となる超微細構造は観察できない。電子顕微鏡は細胞の超微細構造の観察を可能にする分解能をもつが、特定のタンパク質に結合した蛍光タグを「見る」ことはできないので、細胞内に存在するタンパク質の同定はできない。 そこで、「免疫金標識法」が使われる。この手法は、抗体が抗原となる細胞および(または)組織に特異的に結合することを利用して、特定の細胞および(または)組織の存在部位(局在)や形態を電子顕微鏡で可視化する手法である。この手法は凍結超薄切片法(徳安法)を用い、試料に凍結保護剤としてシュークロース(ショ糖)を導入することで、液体窒素(約 <100°C.s-1)に試料を直接沈めて凍結する際に、その比較的遅い冷却速度でも氷結晶の生成を抑えることができる。そして凍結した生体組織をクライオウルトラミクロトーム法で切片化し、免疫抗体金粒子で標識する。
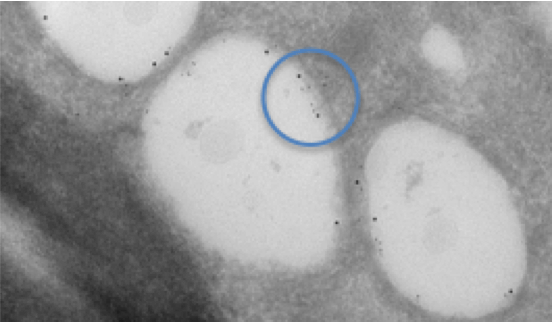
図1. C型肝炎ウイルスに感染した細胞中脂肪滴の免疫金標識法による二重標識。
青色の円は二重標識の個所を指す。異なるサイズの金コロイドで異なる2種類のタンパク質を標識した。各タンパク質が脂肪滴の内膜に個別に局在しているのが分かる。この観察用の組織は凍結超薄切片法(徳安法)で試料作製された。
寄生虫学におけるSEM、TEMによる細胞・分子構造の理解の重要性
マラリアの細胞構造や分子構造の解明は、マラリアの感染を防ぐ医薬の開発に必須である。マラリア寄生虫(熱帯熱マラリア原虫)は、膜で包まれた赤血球の内側で発達し、寄生体胞の中に含まれている。マラリアは発達の過程で赤血球の表面の性質を変え、その細胞骨格を硬直化させてしまい、マラリアが付着した細胞群の細胞骨格に「ずれ応力」をもたらし、さらに伝染していく。そして、マラリア寄生虫が完全に発達を終えると、多段階のプロセスである「egress(感染した後の放出)」が起こる。そのために、原虫は高度に制御された連続的な細胞膜の透過処理と破壊のプロセスを巧みに組織化し、最後は細胞破壊による爆発的な原虫の放出となり、新たな感染サイクルへと展開する。
これらのプロセスを理解することは、マラリアのライフサイクルを明らかにするうえで大切な鍵となる。この研究には電子線トモグラフィーが有効である。電子線トモグラフィーは試料を連続的に傾斜して撮影した多数の画像をコンピューターで画像処理し、試料の三次元内部構造を再構成する手法である。
Fleck教授は、感染した赤血球細胞を高圧下で凍結置換した試料や、赤血球のゴースト細胞を急速凍結した試料をクライオ電子線トモグラフィーで観察し、赤血球細胞表面の三次元的な変化を調べた。電子密度の高い層でコーティングされた渦巻き状の構造で構成された「瘤(こぶ)」状の細胞骨格が高度に組織化され、こぶ状の膜構造の基盤を形成し、複数のリンクで赤血球の細胞骨格に結合していた。Fleck教授はさらに、このこぶ状の構造に存在する膜タンパク質の配置を高分解能・凍結割断SEMで観察した。試料は生きた寄生虫を高圧下で凍結割断することにより作られたものである。膜タンパク質の構造は高分解能のSEM像で明らかになり、こぶ状の構造は周囲の赤血球膜と明確に区別することができ、こぶの頂点は周辺の赤血球への接着部位であることが分かった。このように、熱帯熱マラリア原虫に感染した赤血球のこぶ状の構造は、特定の細胞膜領域の基盤となる高度に組織化された骨格構造を含んでいることが明らかになった。
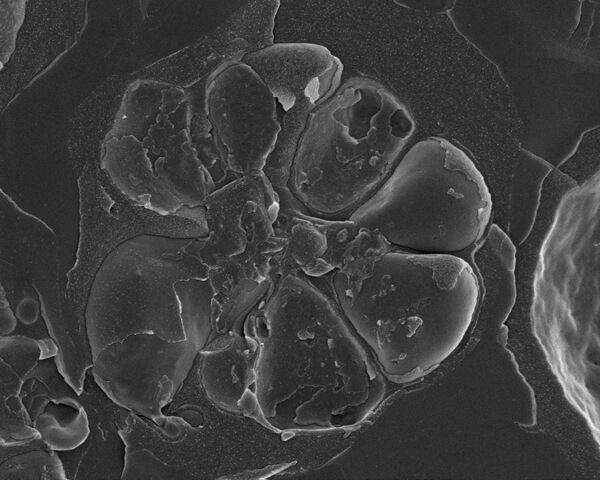
図2. 赤血球の内側で発達するマラリア寄生虫(熱帯熱マラリア原虫)。
膜に包まれた寄生体胞の中には7つのメロゾイト(娘虫体)が含まれており、中心の残余小体の周りに並んでいる。試料の割断処理により、多数の膜が個別に見えている。
シリアルブロックフェイスSEMによる三次元再構成
脳の研究は極めて重要である。なぜなら、脳の中での神経細胞同士の結合を明らかにすることで学習や記憶のメカニズムの理解につながるからである。現在の大きな目標は、脳の中の全ての神経細胞間の結合を明らかにする「コネクトーム解析」である。神経細胞間の結合を可視化する際、TEMは神経細胞同士の結合を観察できるが、観察可能な領域は非常に薄く狭い領域に限られる。「この制限を打破するためには、シリアルブロックフェイスSEM(SBF-SEM)が非常に有効です」とFleck教授は指摘する。
SBF-SEMはSEMにより試料ブロックの三次元構造を再構成する手法である。樹脂包埋した脳神経組織のような、柔らかい試料の三次元像再構築に使う。SEMの試料室に組み込んだウルトラミクロトームを使い、500 μm以上のサイズの脳組織のブロック試料の表面を約30 nmの厚さで切削し、現れた一枚一枚の表面をSEMで撮影する。そして、切削と撮影を繰り返して収集した画像を積み重ねて試料ブロックの三次元構造を得る。
SBF-SEM観察により起こる試料の帯電は、得られた画像データの質の低下につながる。そこで、試料ブロックに導電性を持たせるために使うのがOTO(四酸化オスチウム・チオカルボ―四酸化オスミウム)法である。これはSBF-SEM法が登場するよりずっと以前に開発されたもので、脂質のコントラストを高める手法である。Fleck教授はこの伝統的なOTO法を改良してSBF-SEMに応用し、強い(余分な)反射電子信号を生じさせてしまう大量の染色剤の沈殿物を発生させないよう、組織ブロック試料の均一な染色を可能にすると同時に、試料の高い導電性を実現した。
この手法によりFleck教授は、脳の記憶や学習に基本的な役割を果たす「海馬」において、整然と並んだ神経軸索からの入力を受け取る「(海馬)CA1上昇層」と呼ばれる領域の中のシナプス前終末構造の分布を解析した。そして、複数の領域から得られた画像の積層データを立体像に再構成し、教授の共同研究者が(電気生理学的手法で得た)シナプス入力のデータと脳組織内の参照マーカーを突き合わせた。
樹状突起の興奮性シナプスは様々な大きさを示すが、シナプス前部とシナプス後部の構造の間には強い相関があった。(海馬)CA1の錐体ニューロンの基底樹状突起に形成されるシナプスの終末ボタンは、その位置が細胞体から遠いほど、アクティブ・ゾーン(active zone: AZ、シナプス前部の伝達物質放出部位)のサイズが減少していた。そして、これが、シナプス伝達の短期的な促通(高頻度入力によりシナプス伝達効率が上がること)が細胞体から遠いほど強くなることにつながっている。このようにして、樹状突起上のシナプスの位置に依存した短期的な促通の空間的分布は、シナプス入力の頻回刺激の際にシナプス部から細胞体までに信号が伝わる入力電気信号の減衰を補償し、樹状突起各部位での入力周波数の選択性を微調整しているのである。
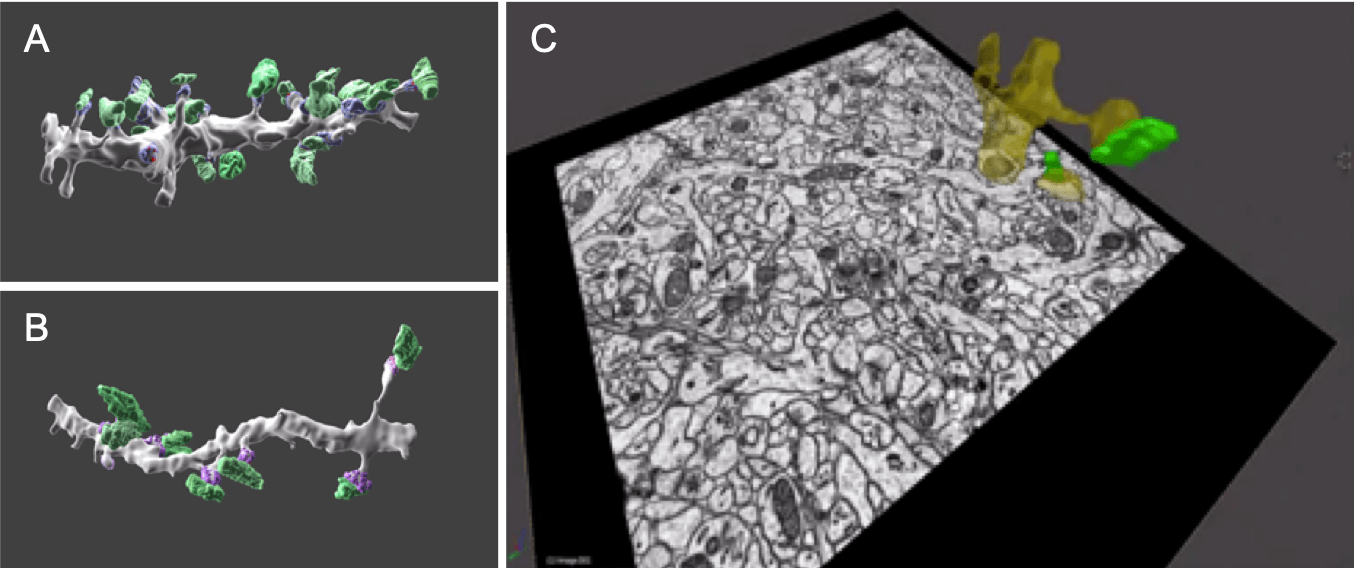
図3. シリアルブロックフェイスSEM(SBF-SEM)による、海馬の神経細胞の三次元再構成画像。
画像AおよびBでは、シナプス前部の終末ボタンを緑色で、シナプス後部の密度を紫色で示す。ここでAは細胞体付近の樹状突起の画像、Bは細胞体から遠い部位の樹状突起の画像である。画像Cは試料ブロックから連続的に切削し観察したうちの一枚のスライスを示す。再構成された樹状突起の部位を黄色で、シナプス前部の終末ボタンを緑色で表示して、スライス像に重ねてある。多数のスライス像を収集し積み重ねることにより、海馬組織の三次元再構成像ができる。
光学顕微鏡と電子顕微鏡を組み合わせた「光・電子相関顕微鏡法」
光・電子相関顕微鏡(CLEM)は、光学顕微鏡と電子顕微鏡の相補的な特長を活用する手法である。まず蛍光標識したタンパク質や組織の位置を蛍光顕微鏡で特定する。次に電子顕微鏡を用いて特定した部分の形態や構造をより高い分解能で観察する。CLEMはバイオサイエンスで広く用いられていて、蛍光標識されたタンパク質、組織の機能、微細な形態(構造)などが解析できる。 CLEMはTEM、SEMのいずれかと組み合わせることができ、さらに特殊なクライオステージを取り付けて蛍光顕微鏡とクライオ電子顕微鏡の相補性を活用することができる。Fleck教授のCUIでは、多数のCLEMワークフローを実施している。例えば、Nikon社の光学顕微鏡と日本電子製 SEMを室温で連携させ、この装置により細胞を特別な組織培養皿で成長させて生きた細胞の観察ができる。これらの組織培養皿は、細胞プロセスの光学顕微鏡観察データと室温処理試料のSEM観察データの相関について考察することを可能にする。
生命科学のさらなる進歩に向けて
クライオ電子顕微鏡法と構造生物学法を組み合わせて、非晶質の氷に包埋した細胞や組織の切片から三次元の細胞構造を「その場」で決定する解析手法は、細胞生物学における新たなフロンティアである。この手法はクライオ電子顕微鏡だけでなく、クライオ固定・クライオ切片作製ツールを必要とする。また最新の集束イオンビーム(FIB)装置とSEMを組み合わせたFIB-SEM (JIB-4700F: 日本電子製)を前述のツールに合うよう最適化することにより、FIB装置で非晶質氷のラメラ(薄膜)試料を作製し、試料汚染が起こらない状態でクライオTEMに試料をスムースに移送して観察することができる。
Fleck教授は次のように語る。「生物学的電子顕微鏡法は最近10年の間に著しい進歩を遂げました。我々は日本電子との緊密な協力により新たな解決すべき課題に挑戦していきます。そして私達は最先端の装置を開発するため、多くのアイデアを意見交換し相互に提案していきます。私はこのような将来のイノベーション事業の一員であることに非常にわくわくしています。」 JCAT(JEOL Centre for Advanced Technology)はさらに、社会に貢献する重要な役割を果たしている。JCATは地元の病院の腎臓病や皮膚疾患の診断にも様々な技術を提供している。例えば、日本電子製 RUBYカメラを搭載したJEM-1400Plus電子顕微鏡で生体検査を簡単に行うことができる。
Fleck教授は次のように強調する。「日本電子とのパートナーを基に設立されたJCATは極めて重要なプラットフォームになるでしょう。この最先端技術センターでは、私達の建設的な協力関係から新しい装置や技法のアイデアが生まれ、生命科学の一層の進展につながることを信じています。」

Roland Fleck
ロンドン大学キングスカレッジ 教授
Fleck氏は応用海洋生物学をヘリオット・ワット大学(エジンバラ、スコットランド: Heriot Watt University in Edinburgh, Scotland)で学んだ後、淡水生物学研究所(Institute for Freshwater Biology)に在籍し「クライオ状態で保存された淡水原生生物の細胞ダメージと回復のメカニズム」の研究で博士号を取得。その研究の間、初めて電子顕微鏡を使い始め日本電子製 JEM-100CXを活用。博士号を取得後、アメリカのコーネル大学(Cornell University)で植物の低温順化を研究。その間、特に「凍結割断・凍結エッチングレプリカ法」に専心。その後イギリスに戻り、英国立生物学的製剤研究所(National Institute for Biological Standards and Control: NIBSC)で細胞に基づいた機能評価・分析法を開発、標準化し、電子顕微鏡法・クライオイメージング施設の展開に携わった。現在はロンドン大学キングスカレッジのCentre for Ultrastructural Imaging (CUI)のディレクター。
掲載:2019年3月
