超高速Magic Angle Spinning法を用いたタンパク質の 固体高分解能NMRの発展
日本電子news Vol.47 No.3
Songlin Wang、 石井 佳誉
Department of Chemistry, University of Illinois at Chicago
はじめに
過去10年間でNMRの分野において最も激しい変化を遂げたのがタンパク質の固体NMR法である。特にここ数年は、アミロイドタンパク質や膜タンパク質などの構造生物学の分野で高難度とされているタンパク質に対して、固体NMRを使ったインパクトの高い研究が多く見られるようになってきた。これを受けて、特に欧米を中心として超高磁場の固体NMR装置への投資が広く行われて来ている。ここでは近年の固体NMR法の進展の原動力となっている 超高速Magic Angle Spinning(MAS)法を使った固体NMRのアプローチを紹介する。
現在、タンパク質の固体NMR 法で使われているのは主に2-3次元の固体高分解能NMR法である。固体高分解能NMR法の中核をなす手法であるCP-MASは1970年代半ばに高分解能スペクトルを得るためのMAS法と1H核から13C核への磁化移動により感度増加を行うCross Polarization(CP)法を組み合わせることで生まれた。CP法により13C信号を準備し、試料を磁場から54.7度傾けて試料を回転するMAS法を用いることで13Cの高分解能固体NMRスペクトルが得られた[1]。初期の実験では3kHz程度でMASを行い、ポリマー等の固体材料の構造解析を行える画期的な手法として導入された。2000年代には多次元NMRの進展と共に、タンパク質等の生体試料で広く使われるようになったものの、小型タンパク質でも5-10mg(1-2µmol)程度の大量の13C同位体ラベルした試料を必要とするという制限から、応用の対象は限られたものになっていた。また、溶液NMRでは比較的早くから1H NMR周波数750-900MHz等の超高磁場装置の普及が進んだものの、固体NMRでは高磁場ではMAS回転によるサイドバンドが出るため、400MHzなどの一時代前の装置がごく最近まで最適とされてきた。
この状況が大きく変わったのはここ10年程の間である。要因としてはMAS高速化により回転速度が30kHzから100kHz程度まで向上し[2-6]、超高磁場であってもサイドバンド等の問題が解決したことと、超高速MASを用いて大幅に感度向上を達成する方法が発達したことが大きい。MASの高速化をするためにはローターの直径を速度に応じて小さくする必要があり、例えば超高速MASに使われている直径が1mm以下のローター(Fig.1参照)では、僅か1mg以下程度の試料が入るだけである。したがって、材料のNMRではともかく、タンパク質の固体NMRを得るのに必要なS/Nが得られないのではという意見が大勢であった。他方で、筆者、Meier(ETH)、Emsley(ENS Lyon)らのグループを中心とした超高速、超高磁場を用いた測定法の開発により[3,5,7-10]、単位試料当たりの固体NMRのS/Nは30-100倍程度になり、1mg以下の生体試料でも3次元NMR等の先端的な固体NMR法が可能となってきている。特に中心となる要素技術としては、固体NMRでは観測の難しい核であった1H核の直接観測と13C核の間接測定[11-14]、超高磁場の固体NMR[3,15]、常磁性試料をタンパク質に混ぜて緩和時間を短くすることで実験の繰り返し速度を上げるPACC法[5]といった方法がある。この様に超高速MAS下で機能するExoticな感度増加技術を相乗的に組み合わせることで大幅な感度の増加が可能となった。
本文では特に超高速MAS下で40年の歴史をもつCP-MAS法が如何に新たな変貌をとげたかを動作原理も含めて簡単に述べる。生体系への応用として、1H観測法を用いた固体NMRによる微量タンパク質試料の解析の研究例を紹介する。
 |
【Fig.1 超高速MAS用の (左)JEOL 0.75-mm MASローター (中)JEOL 1-mm ローター 通常の高速MAS用の (右) Varian 2.5-mm ローター 比較のため直径19mmの米国1セント硬貨と撮影。】 |
実験、結果、考察等
Fig.1に本研究で用いた3つのMASローターを比較した写真を示す。コインは米国の1セント硬貨(直径19mm)で日本の1円硬貨よりも一回り小さい。左から直径が0.75mm、1mmのJEOL製の超高速MAS用のローターで、一番右が通常の2.5mm MAS用ローターである。どれだけ試料の量に違いがあるか一目瞭然であろう。2.5mmローターも30kHzまで回転し通常は高速MAS用とされているものであるが、0.75mmと1mmのローターは大幅にサイズが小さい。 Fig.1から、このプロジェクトの当初は極小のMAS用ローターを使ってタンパク質の固体NMRに十分な感度が得られるか、どうして多くのNMR研究者が懐疑的であったことがお分かり頂けるであろう。
次に、超高速MAS下でのCP-MAS法の原理を通常の方法と比較して簡単に説明する。Fig.2に(a)超高速MAS下で使われるCP-MASのパルス系列と(b)通常のCP-MASのパルス系列を比較したものを示す。通常のCP-MAS法ではまず90度パルスで1H側の磁化を励起したあと、CPで1Hから13Cに磁化を移動し、その後で13C核を高分解能で観測する。この観測の際に1H核を高出力のRF波で照射して、デカップリングと呼ばれる操作が必要となる。これより、線幅の増大の原因となる1H-13C間の双極子カップリングを除くことができる。SPINAL-64等のデカップリング用パルス系列に必要なRF波の強度は周波数にして60-100kHz程度で、10-40kHz程度の1H-13C双極子カップリング(D)の相互作用よりも大きく設定する必要があるため高出力を用いる必要がある。また、少し専門的になるが現在CP法で広く使われているadiabatic CPパルス系列[16]ではFig. 2(b)に示すように13C(もしくは1H)側のRF強度を変化させて、CPによる磁化移動のために以下の条件を満たすようにする。
<νH> – <νC> = nνR, ........(1)
ここで<νH> と <νC>は1Hと13C側に照射するRF波の平均強度、νRはMAS回転速度。n が±1,±2となるときに磁化移動が起きる。ここでの要点はνRが小さいときには1Hと13Cを同強度程度の強いRF波で照射する必要があること(<νH> ~ <νC>)である。
他方でFig. 2(a)に示すように超高速MAS下では10kHz程度の弱い1H核へのRF波を用いた低出力デカップリング下で13Cの信号を観測する[3,17]。これはMASの回転速度(80-100kHz)が大幅にDを超えるため、MASによる平均化でほぼ1H-13C双極子カップリングを除けるためである。消え残った残余のカップリングは10kHz程度の低出力のRF波の照射で除去できる。RF波の照射により発生する熱はRF波の強度の2乗に比例するため、低出力デカップリング下では通常の高出力デカップリングと比較すると試料の発熱による試料の劣化の恐れがほとんど無い。関連して、低出力デカップリングにより発熱を押さえることで、緩和試薬をタンパク質に混ぜて非常に早い実験繰り返しで測定を行えるようにする筆者らが開発したPACC法という感度増加法が利用可能になる[5]。次に超高速MAS下でのCP法について触れるが、条件(1)をそのまま使うと非常に大きなRF波を使う必要がでてくる。例えば、n=1の場合、<νH> =<νC>+νRとなるので<νC>を70kHz、νRを100 kHzに設定した場合<νH>は170 kHzものRF波が必要となり、試料の発熱の問題からしても不都合である。そこで超高速MAS下ではDouble-quantum CP(DQ-CP)という異なる原理のCP法を用いる。このDQ-CP法ではCPによる磁化移動のための条件は以下のようになる。
<νH> + <νC> = |n|νR. ......(2)
n=1の場合は<νH> =νR-<νC>となり、両者ともνR以下で収まる。例えば、<νC>を70kHz、νRを100kHzにした場合には<νH>は30kHzになり、比較的低出力でのCPが確立できる。
以下に実験の実例を示す。Fig.3に標準的なテスト試料である均一13C, 15NラベルしたL-alanineのCP-MASを(a)100kHzの超高速MAS下で超高磁場の17.6T(1HNMR周波数750.1MHz)で得たスペクトルと(b)通常の20kHzのMAS下で通常の磁場の9.4T(1HNMR周波数400.2MHz)の条件で得たスペクトルを比較したものを示す。Fig.2(a)のデータはJEOL製のローター径0.75mmの4重共鳴のCP-MASプローブを用いてFig.2(a)のパルス系列で得たものである。僅か10kHzの強度の1H核のRFデカップリングを使っているにも関わらず、(b)で得た85kHzの高出力デカップリングを使って得たスペクトルよりも分解能が良いのが明らかである。高磁場化による分解能の向上と共に、超高速MASと低出力RFデカップリングによる二段構えで線幅の広がりを除く仕組みも高い分解能に大きく寄与している。もう一つ、着目すべき点は必要な試料の量である。上で述べたように超高速MAS法では高速回転に伴う設計上の制約から、試料の量が制限される。(a)ではわずか0.3mgの試料を用いて測定している。これに対して(b)では5.9mgの試料を用いている。約20倍の試料差があるにも関わらず、(a)のS/N比は(b)の約1/2と両者が比較できるレベルになっている。スキャン数、待ち時間、信号取り込み時間等の条件は同じに設定してある。従って、単位試料当たりの感度(mass sensitivity)は超高速MASと高磁場の条件で取った(a)のデータでは従来法のCP-MASにより取られた(b)と比較して約10倍にもなる。この非常に良い感度は高磁場化の他に、ローターのサイズに合った極小コイルを検出器として持つプローブ回路の高い効率に寄るところが大きい。このように高磁場化と超高速MASの組み合わせで単位試料当たりの感度が一桁も上がったことには大きな意義がある。またこの結果は今後の高磁場に最適化した超高速MASプローブ開発の重要性を示している。
次に超高速MASを用いたタンパク質の微量試料解析の例を示す。従来のタンパク質の固体NMRでは高磁場を使った先端の手法でも概ね0.3-1μmol程度の試料が2-3次元NMRを得るのに必要であった。例えば分子量1万程度の小さなタンパク質でも3-10mg程度の多くの試料量が必要となる。本研究では、超高速MASの特徴を生かして、1H核の観測と立体特異的に重水素標識するSAIL法で同位体ラベルしたタンパク質を用いて感度の増加を計る。高磁場化と高効率なプローブで得た感度増加の上に更に感度増加を相乗的に重ねる戦略である。SAIL(stereo-array-isotope labeling)法[18]は首都大学のKainoshoらによって開発された安定同位体の標識方法で溶液のタンパク質NMRで同じ化学基中の1H-1Hカップリングを除いて大きなタンパク質に対する分解能を高めるのを目的として開発された。この標識法では通常の13C、15Nラベルの他にCH2は立体特異的にCHDに、CH3はCHD2にラベルされている。これまでにSAIL法で標識したアミノ酸に対し固体NMRが30kHzの高速MASで行われたが、1Hの線幅が0.5-0.7ppm程度と分解能は十分でなく[19]、タンパク質へのスケールアップは困難であった。ここでは超高速MASとSAILラベルを組み合わせて効率よく1H-1H双極子カップリングを除くことで、タンパク質の1H固体NMRの感度と分解能の大幅な増加が期待できることを示す。Fig.4(a)に1H観測で得たSAILラベルしたタンパク質であるユビキチンに対する2次元1H/13C固体NMRスペクトルを示す。通常の13C観測であるとデータはJEOL製のローター径1mmの4重共鳴CP-MASプローブで17.6Tの磁場を用いて得た。ユビキチン中の7つのIleをSAILラベルしている。超高速MAS、超高磁場、SAILラベルのトリオによる1Hの分解能の向上は素晴らしく、線幅は0.1-0.2ppm程度である。このため、7つのIleの信号がほぼ全て2次元スペクトルで分離できた。また、試料の量はわずか0.5mg(55 nmol)にも関わらず非常に感度の良いスペクトルが5分で得られた。試料を1/5にすると25倍の時間が掛かるので、10nmol(90μg)程度の試料しか用意できなくても2時間もあれば実験が可能となる。大幅な感度増加が1H観測の高磁場固体NMR、超高速MAS、SAILラベルの組み合わせで可能となることを示している。
Fig. 4(b)は同じSAILユビキチン試料を通常の13C観測で得た2次元1H/13C固体NMRを示す。同じ実験時間で同じ情報を持つデータを得ているが明らかに1H観測のデータの方が大幅に感度が良い。(d-e)と(f-g)で示すように同じ位置でスライスを取って矢印で示す同じ信号のS/Nを比較することで、感度が1H観測で5.4-9.7倍にもなっていることを示した。同様に1次元の13C観測で得たスペクトルである(c)と比較しても感度は2.1-5.0倍となっている。これは、1H核を間接観測した2次元1H/13C固体NMRにより13C観測の1次元スペクトルと比較して感度増大した初めての例となる。この結果は、通常の13C観測2-3次元固体NMRに1H観測を組みこんで1H観測3-4次元NMRにすることで、大幅に感度と分解能が向上することを示している。我々のグループは同じユビキチン試料を使って、わずか2.5時間で1H観測した3次元1H/13C/13C固体NMRが得られることを示し、7つのIle側鎖の信号がほぼ完全に帰属できることを示した。10nmol(90μg)の試料を想定しても、ほぼ3日程度の測定で実験が可能となる。つまり、nmolスケールのタンパク質でも2-3次元固体NMRがルーチン的に可能となる新たな時代の到来を示唆しているといえよう。
最後に、本論文で紹介した超高速MASと高磁場を使った固体NMRのアプローチにおけるプローブデザインの最適化の重要性を指摘したい。Fig.5はFig. 4と同じSAILユビキチンを一時代前のプロトタイプのJEOL製の2重共鳴1mm CP-MASプローブで測定したものである。この時点ではJEOLは超高速MAS実験における温度可変装置の重要性を理解していなかったので、温度可変装置はUICで自作した。実験は800MHzで行い、測定条件は実験時間と2Hデカップリングを行っていないことの他はほぼ同等である。Fig. 4とほぼ同じ実験時間でスペクトルが得られているが、実験時間は10倍の50分である。このテスト結果をふまえて、Fig.4で用いたJEOL製の4重共鳴1mm CP-MASプローブが開発された。JEOLのプローブ開発チームはこの新しいプローブで1HのRF回路の効率を大幅に向上した。また、このプローブには温度可変実験用の冷却空気を通すガラス2重管と2Hデカップリング用の装置を組み込んである。Fig.6にSAIL L-イソロイシンの(a)2Hデカップリングありと(b)2Hデカップリング無しの場合のCP-MASスペクトルを示す。10-30ppmの領域にあるCHDとCHD2の信号が大幅に感度増加しているのが明らかである。この1mmプローブの成功を基にFig.2で用いたJEOL製の4重共鳴0.75mm CP-MASプローブがデザインされた。このマイクロコイルと超高速MASモジュールをもつプローブの回路が最適化されれば更に2-3倍のmass sensitivityの増加があっても不思議ではない。また、今後数年の間には1H NMR周波数1 GHzを超える高磁場磁石に対しての超高速MASプローブの開発への需要が高まっていくと予想される。
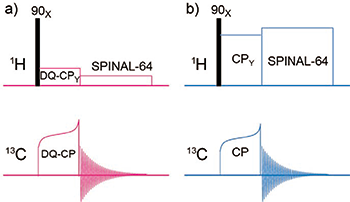 |
【Fig.2 (a)超高速MASに適した低出力のCP-MASパルス系列と (b)通常のCPと高出力デカップリングを用いたCP-MAS パルス系列。】 |
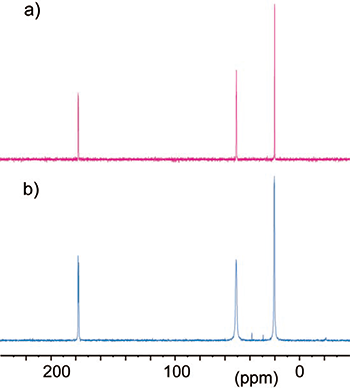 |
【Fig.3 均一13C-, 15N-ラベルしたL-alanineの13C CP-MASスペクトルの比較。(a)100kHzの超高速MASと低パワーのパルス系列を用いて1HNMR周波数750.1MHzの高磁場で得たスペクトルと(b)通常の高出力デカップリングを用いて20kHzのMASを用いて1HNMR周波数400.2MHzで得たスペクトル。データはそれぞれ(a)JEOL 0.75-mm 4重共鳴CP-MAS プローブと(b)Varianタイプの2.5-mmスピニングモジュールを搭載した自作の3重共鳴CP-MASプローブで得た。(a)では13C信号をadiabatic DQ-CPパルス系列で準備し、低パワーのSPINAL-64 1Hデカップリング系列を10kHzで照射して観測した。(b)では13C信号を通常のadiabatic CP系列で準備した後、高出力1H TPPM デカップリング系列を85kHzで信号を観測した。(b)の試料は基準信号となる5.9mgのadamantineと混ぜてある。L-alanine試料の量は(a)が0.3mgで(b)が5.9mg。(a, b)共に信号のスキャン数は4回。】 |
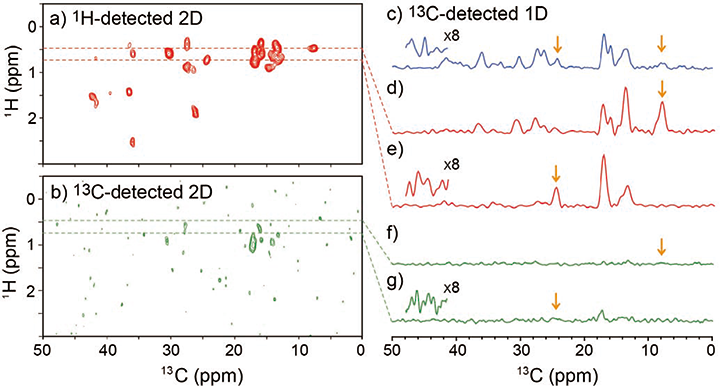 |
| 【Fig.4 (a)1H観測と(b)13C観測で得たSAIL法でラベルしたユビキチンの2次元13C/1H相関スペクトルと(c)13C CP-MAS スペクトル。試料の量は~0.5mgでMASの回転周波数は80kHz。(d‒g)S/N比較のための1Dのスライス。1Hシフトの位置は(d, f)0.43ppm(e, g)0.69ppmで、それぞれ(d, f)は1H観測と(e, g)13C観測の2次元スペクトルより得た。全てのデータはJEOL製の1-mm CP-MAS 4重共鳴プローブと17.6Tの磁場を用いて得た。 (a‒c)中の各スペクトルの測定時間は約5分。パルス系列は参照文献10参照のこと。スペクトルは参照文献10より改変 。】 |
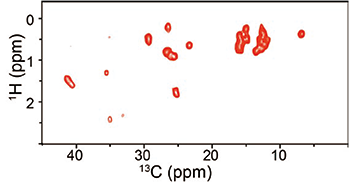 |
【Fig.5 初期型の1-mm CP-MAS 2重共鳴プローブにより同じSAILユビキチン(~0.5 mg)から得た1H観測2D 13C/1Hスペクトル。回転周波数は80kHzで1HNMR周波数800MHzの磁場で得た。実験条件はFig.4の(a)と2Hデカップリングが無いのと、実験時間が違うのを除けばほぼおなじ。スペクトルの測定時間は約50分。】 |
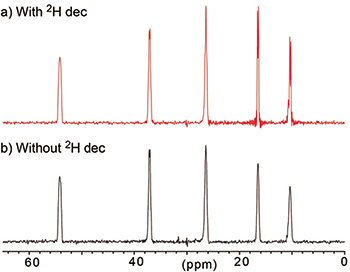 |
【Fig.6 SAIL L-イソロイシンの13C CP-MASスペクトル。(a)2Hデカップリングが有る場合と(b)無い場合を比較した。信号観測中の2H WALTZ-16デカップリングの照射強度は0.25 kHz[10]。両者とも1Hデカップリングは行っている。回転周波数は80 kHzで1HNMR周波数750.1 MHz。CHD, CHD2では明らかに2Hデカップリングが有る場合の方が感度と分解能が良い。】 |
結論
NMRの分野は既に成熟した分野とされてきたが、最近の固体NMRの装置と方法論の開発の勢いは凄まじく、急激に感度と分解能の向上が進んでいる。ここでは超高速MASと超高磁場装置の固体NMR装置への感度のインパクトを紹介した。また、1H観測により通常の13C観測に比べて感度が10倍にまでなる例を紹介した。80kHzでの超高速MAS、1H観測とこれまでタンパク質の固体NMRでは使われてこなかったSAIL法を組み合わせた成果である。こういった成果の相乗効果により、従来1μmolもの試料が必要であったタンパク質の多次元固体NMRによる解析が数nmolかnmol以下で可能となる時代がすぐそこまで来ている。
謝辞
We thank Dr. S. Parthasarathy for his contribution to this work at UIC. We also thank Drs. Y. Endo, T. Nemoto,Y. Nishiyama, and Y. Ishii at the JEOL Resonance for their development efforts of 1-mm and 0.75-mm CP-MAS probes used for this work. The SAIL ubiquitin and samples was provided by Prof. M. Kainosho at the Tokyo Metropolitan Univ. This study was supported primarily from the U.S. National Science Foundation(CHE 957793 and CHE 1310363)and the Dreyfus Foundation Teacher‒Scholar Award program for YI. The instrumentation of the 750 MHz SSNMR at UIC was supported by an NIH HEI grant(1S10 RR025105).
参考文献
- Schaefer, J.; Stejskal, E. O. J. Am. Chem. Soc 1976, 98 ,1031.
- Nishiyama, Y.et al. J. Magn. Reson . 2011, 208 , 44.
- Parathasarathy, S.; Nishiyama, Y.; Ishii, Y. Acc. Chem. Res. 2013, 46 , 2127.
- Samoson, A. In 41st Experimental Nuclear Magnetic Resonance Conference Asilomar, CA, 2000.
- Wickramasinghe, N. P.et al. Nature Methods 2009, 6 , 215.
- Laage, S.; Sachleben, J. R.; Steuernagel, S.; Pierattelli, R.; Pintacuda, G.; Emsley, L. J. Magn. Reson . 2009, 196 , 133.
- Wickramasinghe, N. P.; Kotecha, M.; Samoson, A.; Past, J.; Ishii, Y. J. Magn. Reson . 2007, 184 , 350.
- Bertini, I.; Emsley, L.; Lelli, M.; Luchinat, C.; Mao, J.; Pintacuda, G. J. Am. Chem. Soc . 2010, 132 , 5558.
- Huber, M.; Boeckmann, A.; Hiller, S.; Meier, B. H. Physical Chemistry Chemical Physics 2012, 14 , 5239.
- Wang, S. et al. Plos One 2015, 10 , e0122714.
- Ishii, Y.; Tycko, R. J. Magn. Reson . 2000, 142 , 199.
- Ishii, Y.; Yesinowski, J. P.; Tycko, R. J. Am. Chem. Soc . 2001, 123 , 2921.
- Zhou, D. H.; Shah, G.; Cormos, M.; Mullen, C.; Sandoz, D.; Rienstra, C. M. J. Am. Chem. Soc 2007, 129 , 11791.
- Marchetti, A.et al. Angew. Chem. Int. Edit . 2012, 51 , 10756.
- Bertini, I.et al. Chemical Science 2011, 2 , 345.
- Hediger, S.; Meier, B. H.; Ernst, R. R. Chem. Phys. Lett . 1995, 240 , 449.
- Kotecha, M.; Wickramasinghe, N. P.; Ishii, Y. Magn. Reson. Chem . 2007, 45 , S221.
- Kainosho, M.; Torizawa, T.; Iwashita, Y.; Terauchi, T.; Ono, A. M.; Guntert, P. Nature 2006, 440 , 52.
- Takahashi, H.; Kainosho, M.; Akutsu, H.; Fujiwara, T. J. Magn. Reson . 2010, 203 , 253.
