生きたまま濡れたままの試料を高真空下で観察可能にするNanoSuit®法
日本電子news Vol.47 No.4
針山 孝彦
浜松医科大学 医学部
われわれは、ショウジョウバエの幼虫が細胞外に分泌し体表面を保護する粘性の細胞外物質(ECS: Extra Cellular Substance)に電子線やプラズマを照射することで、高真空下でも乾燥することなく生きた状態で高分解能走査型電子顕微鏡を用いて観察が可能にすることができる事を見出した。電子線あるいはプラズマ照射によってECSが重合することでナノ薄膜が形成され、生体内部に含まれる気体や液体が高真空環境下でも保持されたためである。生物を規範とするバイオミメティクス的発想により、ショウジョウバエのECSの模倣として界面活性剤(Tween-20)などの生体適合性物質を選択し、これを生体表面に塗布しプラズマ重合することで生きたままでの高分解能電子顕微鏡観察を可能とした。走査型電子顕微鏡内で、生きた状態でさまざまな生物の表面微細構造や運動等を直接観察できる“NanoSuit®”法は、高真空環境下で生きたまま濡れたままのさまざまな試料の観察を可能とすることができる。
はじめに
17世紀の初め、ヨーロッパ各地で光学顕微鏡が使用されるようになった。1830年代に至って生命科学の分野においては「すべての生物は細胞から成っている」という細胞説と呼ばれるパラダイムシフトに結びついた。その後、可視光の代わりに電子線を用いた電子顕微鏡の開発が20世紀の中頃に着手され、高い分解能を用いた多様な研究や技術開発が行なわれるようになった。生命科学の分野では細胞小器官やウイルスなどが発見された結果、生命の理解が格段に広がり、細胞の仕組みや病気の解明がなされるなど、多くのパラダイムシフトを迎えた。
ところが、高分解能な電子顕微鏡になればなるほど電子線が透過できる高真空環境状態が不可欠であるために、体内のガスや液体が奪われ体積が収縮し、体形だけでなく微細構造も大きく変形してしまう。そのため、可能な限り生きた状態に近い微細構造を維持しようと、電子顕微鏡の歴史と共に、観察のための数々の処理法が編み出されてきた。できるだけ生きている姿に近い姿の化学固定を施した試料を観察する方法である。一方で、できるだけ生の試料を観察したいという欲求のもと、走査型電子顕微鏡(SEM)では、ガスや液体の離脱を押さえるために低真空下での観察装置(低真空SEMや環境SEM)が開発されたが、完全に液体の蒸発を防止することは難しい。生きたままの生物の微細構造を、高分解能を維持して観察できたら、生命科学の研究に貢献できることは明らかであるが、その道は閉ざされていた。生きている生物を電子顕微鏡で観察できるわけがないと固く信じられていたからだ。われわれは、その迷信を払拭することを試みた。
高真空環境下で生命維持できないか
1960年代に、試料室が真空度10-2Pa以下の当時の電子顕微鏡を用いて、生きた甲虫をそのまま観察したという報告[1]があった。この論文は生命を電子顕微鏡内で生のまま観察する可能性を示しているようで我々を勇気づけた。高解像度を誇る電界放射型SEM(FE-SEM、試料室真空度10-3~ 10-5Pa)で、誰もが簡単に観察可能にするために、研究の第一段階として、さまざまな生物を網羅的にFE-SEM下でそのまま観察した。当たり前のようにほとんどすべての生物は真空環境におかれると、脱気・脱水され押しつぶされたような姿になり生命は奪われた(Fig.1(a)~(c))。しかし、粘性をもつ細胞外物質(ECS)を個体の最外層にもつ一部の生物(ショウジョウバエをはじめとする双翅目昆虫の多くの幼虫)では、体積収縮のない微細構造表面を観察できるだけでなく、FE-SEMの中で活発に動いていることを発見した。この個体は、観察開始後から1時間過ぎてもその形態は変化しない(Fig. 1(d))。
試料をFE-SEMの中に入れてすぐに電子線照射(Fig.2(a))して、つまり試料室が真空になった状態ですぐに観察を始めると、観察開始から1時間を経てもショウジョウバエの幼虫はその形を維持し、動き続けていた(Fig.2(b,c))。しかし、同じFE-SEMの中で、電子線照射をしないで高真空に曝し、1時間後に電子線照射をして観察すると平らに変形していた(Fig.2(g))。つまり、生物が電子線に暴露されることが高真空の環境下で生命維持するために必要であることを暗示したのである。このウジの最外層を透過型電子顕微鏡(TEM)で観察すると、電子線暴露していないものでは観察されない層(Fig.2(h))が、電子線暴露したものでは新たに加わっており(Fig.2(d))、丹念に観察すると、体中をすっぽりと覆っていた。 ECSが、電子線重合によって極薄い薄膜の宇宙服のような素材となり、全身を覆っていることによって生命維持につながっていたのである。そして、その観察した幼虫を電子顕微鏡から取りだして飼育を続けると外見的には全く正常な成虫になった。我々は、その極薄い薄膜で生命維持するものをNanoSuit®と名付けた。
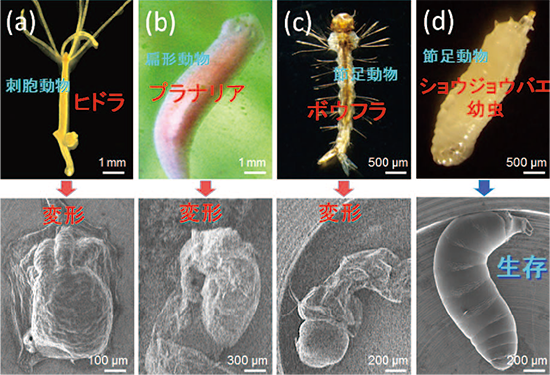
【Fig.1 種々の生物を電界放射型走査電子顕微鏡(FE-SEM)に入れると変形する(a)~(c)が、ショウジョウバエの幼虫(d)だけが高真空環境下で変形せずに生き続けた。】
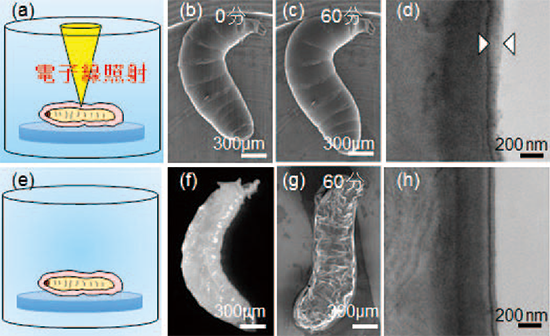
【Fig.2 ショウジョウバエに電子線を照射しながらSEMの中で観察すると、観察開始から1時間を経ても変形せずに、SEMの中で動いていることが観察された((a)~(c))。同じSEMのチャンバー内で電子線照射による観察を行わずに(f)の光学顕微鏡で動きを確認した試料をいれると、1時間後に電子線を照射して観察すると平らに潰れていることがわかった。TEMで観察すると、生きて動いていた試料には、矢頭で示したNanoSuit®が形成されていた(d)が、電子線による観察をしなかったものには形成されていなかった (h)。】
すべての昆虫を観察可能に−バイオミメティクス的発想として界面活性剤を利用
Fig.1に示した生物だけでなく多様な生物をSEMに入れてみたが、双翅目幼虫などを除いて、観察したすべての生物はSEM内では生命維持させることはできず数分間以内に大きく変形してしまった。ショウジョウバエ幼虫のECSが成膜することで生命維持できるのであれば、このECSを分析して物質を調合すれば生命維持できるのではないか。種々の解析を行ったが、生物がもつ多様な高分子のために生命維持に重要なものを特定することはできなかった。そこで、ECSに代わる溶液を生物表面に加え重合させることで、NanoSuit®作製ができないだろうかという発想の転換をした。
種々の試行錯誤を繰り返したが、ECSを規範とした物質として電子線・プラズマ重合による成膜でき、かつ生体適合性物質として食品添加物にも指定されているPolysorbate 20(Tween 20)を選択した。ボウフラをそのままプラズマ照射してFE-SEMで観察すると、体の収縮による変形が起こり数分の間に扁平になる(Fig.3(a)~(d))が、1% Tween 20水溶液をごく薄く塗布し濾紙などの上に置いて余分な溶液をできる限り除いた後、プラズマ処理をしてからFE-SEM観察すると、高真空下でも体積収縮がなく(Fig.3(f)~(i))生きたまま微細構造が観察できる。また、ボウフラは微細構造観察時にも活発に活動しており、観察後に飼育水に戻すと、一週間ほどで蚊に成長した。ボウフラの断面のTEM観察を行うと、NanoSuit®で被覆した試料からはショウジョウバエの幼虫のECSの場合と同様に、最外層に50~100nmの薄膜が形成されていた(Fig.3(j))。バイオミメティクス的発想による幼虫のECSを規範としたTween 20でもNanoSuit®を形成させることができ、FE-SEM観察により生きた状態の微細構造を観察できる。バイオミメティクス素材による生命維持に成功した[2],[3]。

【Fig.3 ヒトスジシマカAedes albopictusにプラズマ照射(a)だけしてSEMに入れて観察すると、挿入した直後から体積収縮が始まり(b)、30分経過すると(c)矢頭で示したチャージが始まる。高倍率で観察すると、矢印部分には皺がより、矢頭で示した部分に峰が形成されていた(d)。一方、1% Tween20溶液を塗布し、よく溶液を拭ってからプラズマ処理したものでは、ボウフラはSEM内で生き続け(運動も維持され)、高倍率観察でも構造の規則性が保たれていた。TEMで観察すると、矢頭で示したNanoSuit®が形成されていた(i)が、塗布しないものには薄膜の形成は観察されなかった(e)。】
NanoSuit®の電子線透過性
生物表面の外側にNanoSuit®が覆っている時に必ずしも均一に平らに広がっているわけではない(Fig.4(c)矢頭)のに、なぜ生きている状態の超微細構造が観察できる(Fig.4(b))のだろうか。 1% Tween 20水溶液をボウフラに浸してNanoSuit®化させた後に金粒子を蒸着してボウフラ表面を観察する(Fig.4(d))と微細構造は消失し、のっぺりとした面が観察される(Fig.4(e))。この表面をTEMで観察するとNanoSuit®が微細構造を覆い、その表面上部に金粒子が存在していることがわかった(Fig.4(f)、矢印直下の黒い層)。生物表面に装着させたNanoSuit®は、生物体内のガスと液体成分の放出を防ぐだけでなく、実効的に透明であるために超微細構造を観察することが可能であることがわかる。また、金が表面を覆うと、低倍率の観察は可能であるが、高倍で高解像度の観察はできなくなることも示された。
ショウジョウバエの幼虫が分泌するECSやTween 20などの分子は軽元素なので密度が低く電子線が透過しやすい。そのことによって、電子顕微鏡内で透明な服として機能するのだろうと考えている。いかに電子線を通しやすいものでも、高濃度の50% Tween 20水溶液のようなものを塗布すると結果として厚く被ってしまうことになり、全体の姿を低倍で観察する事はできても、微細構造は観察できなくなってしまうので、使用する溶液の濃度に注意することが必要である[4]。また、市販されているSEM用溶剤のように、イオンとしての導電性があるものだと、生体適合性がないために生きた生命体を観察できないだけでなく、その物質自身が二次電子・反射電子を出してしまうので、その溶剤の粘性と相まって生体の微細構造を観察することは難しい。
これまで行われてきた電子顕微鏡観察のための前処理では、早くて丸一日、長いと数日の処理が必要であった。固定・脱水処理に時間が必要だったからである。しかし、NanoSuit®法では、3~5分程度の処理で、生きたままSEM観察することができる。

【Fig.4 ヒトスジシマカAedes albopictusボウフラの表面にNanoSuit®を塗布すると生命維持され(a)、超微細構造が観察される(b)。しかし、TEMで観察すると必ずしも均一に平らに広がっているわけではなく、(c)の矢頭で示したように、場所によって不均一に広がっている。そのNanoSuit®の上に金属蒸着すると(d)と表面の微細構造は観察不可になる(e)。TEMで観察すると(f)の矢印で示したように、金属粒子の蓄積が観察される。】
従来法とNanoSuit®法による観察結果の比較
固定・脱水・金属蒸着という従来法の処理を施したもの(Fig.5(a)~(d))と、NanoSuit®法(Fig.5(e)~(h))による観察を比較すると、顕著な差があることがわかる。ここで例として取り上げたハマトビムシ(Talitrus saltator )は、地中海地域の砂浜に生息する濡れた場所を好む生物で、乾燥することを避け、また濡れすぎることを避けるために得意な行動を示すことがさかんに研究されている甲殻類・端脚目の動物である[5]。従来法の観察では、各体節がはっきりと分かれている(Fig.5(a))が、NanoSuit®法を用いるとそれぞれの節は滑らかになり境目の凸凹がない。触角を高倍にして観察すると、感覚毛(矢印)の先端部が(cf.Fig.5(b)(f),(c),(g))従来法では分かれているが、NanoSuit®法ではすべて直線的に並び尖端が集まっている。また触角の尖端も同様に大きな違いが観察される。常にどちらが本当の姿であるかという疑問は残るわけではあるが、規則性があり、生物が生きている状態であるという背景から、NanoSuit®法による観察結果の方が、より生物の生きている姿を反映しているだろうと我々は考えている。

【Fig.5 ハマトビムシT. saltator の従来法(a)~(d)と、NanoSuit®法(e)~(h)による比較。】
NanoSuit®開発に基づく自立薄膜作製
生命維持することができるNanoSuit®は、溶液を高真空に曝し電子線あるいはプラズマを照射することで形成する。この薄膜を独立して作り出す事ができれば、多くの工学的応用に資することができる。例えば、Tween 20のように水溶液にしたものをガラス表面にスピンコートし(Fig.6(a1))、プラズマ照射する工程(Fig.6(a2))により種々の薄膜を形成させることができることがわかった。これを蒸留水に薄膜を上側にして水にガラス基盤ごとゆっくりと沈めると、自立膜を単離する事ができ(Fig.6(a3))、この膜を窓の空いたプラスチック基盤の上に掬いだして、自立薄膜の性質を調べる事が可能である[6]。この溶液から簡易に作成できる自立薄膜作成法は、工業利用など多様な応用科学の範囲で利用されることになるだろう。
また、これらの自立薄膜は、多様な生体適合性物質から作製することができ[5]、医療用シートとしての将来性も非常に高い。
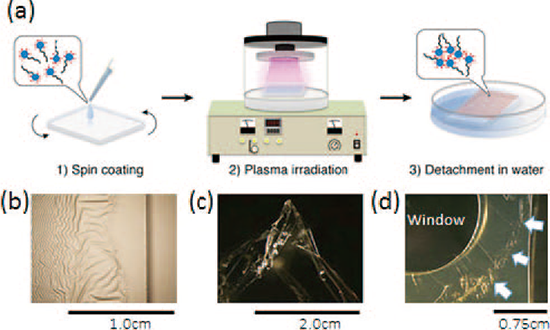
【Fig.6 (a)溶液からの製膜の方法。 1)溶液の状態でスピンコート、 2)プラズマ照射、 3)溶液内に膜を浮かべる。(b)プラズマ処理したガラス基盤上の膜。(c)蒸留水中の自立薄膜。(d)プラスチックの機材に窓を開けて、そこに自立膜を平坦に貼り付けたもの。(d)の矢印は自立薄膜の端を示す。】
おわりに
『生きたままの生物のFE-SEM高分解能/高解像度観察』は、バイオミメティクス研究推進のため、節足動物の表面構造をできる限り生きたまま観察する必要から取り組むことになった。バイオミメティクス研究では生物の構造や機能などを規範として工学応用を目指しているために、できる限り規範とする構造が生命そのものを反映している必要がある。手始めに手当たり次第に生物を電子顕微鏡に入れ、それぞれの生物の対真空性に注目したことが幸いした。その結果、生物適合性のある化学物質でNanoSuit®を作成する技術に結びつき、結果として、電子顕微鏡内で動的観察を行う方法として確立することができた。まさに生体の超微細構造を電子顕微鏡内で“生態”観察することができるようになったといえる。
生物は、ホイッタカーの五界説で代表されるように、原核生物(モネラ)界、原生生物界、植物界、菌界、動物界と分類されることがあるが、現在はこれらの生物のほぼすべてを、NanoSuit®で生命維持することにより高真空電子顕微鏡内で高解像度での観察が可能になった。
このNanoSuit®は医療応用も可能である。これまでの技術を改良し、濡れたままの固定組織(病理)標本を用いた解析および診断、あるいは、これまで誰も観ることのなかった組織と細胞、細胞同士の超微細構造の連関も可視化できるようになった(論文準備中)。患者から摘出した組織を数分間の処理で超微細構造を観察できる。手術室の横に電子顕微鏡を設置し、数分の処理で超微細構造まで生検し医師の判断を助けることにより世界的な規模で健康管理に寄与できるものと考えている。医学部に所属する我々は、絶好のポジションに恵まれ医学上の研究体制が整ったといえる。
また、手軽に超微細”生態”観察できるNanoSuit®は、あらゆる生体現象の観察に可能であり、農学などの応用科学の分野でも期待されている。たとえば、微細な花や虫の観察など、これまでの電子顕微鏡観察法では観察前処理によるアーティファクトによって不可能だったものの観察も手軽に行うことができる。このように、生きたままの生物の高倍・高解像度観察をより多く実施することによって、生体測定用ツールの完成度を高めて、基礎科学や応用科学の分野で新たなパラダイムシフトに貢献できることを目指し続けていきたい。
そのためには、NanoSuit®そのものの開発と共に、電子顕微鏡の開発もともに実施し、また一方で、NanoSuit®の膜だけの工学利用も大きく展開していく必要がある。
本技術開発は、完全にわれわれ研究チームの独創的な発想であり、世界に類を見ない物である。現在は、国内外の「学」を中心に多くのNanoSuit®法を用いたフォロワーが出現している。また「産」である企業の研究所のフォロワーの出現も確認している。しかし、本研究を発展させるためには、多様な生体適合性物質の組み合わせによるNanoSuit®の最適化、それを重合させて成膜のための最適化、電子顕微鏡内での動的観察の最適化、などなど、大規模な研究チームとそれに伴う予算が必要である。海外の研究のフォローアップに慣れてしまっている国内の体質から脱却して、我が国発の世界に例をみない研究への投資を行う「官」や「産」の本格的なサポートを期待したい。
謝辞
本研究は、高久康春、鈴木浩司、太田勲、村中祥悟、河崎秀陽、平川聡史、筒井孝朱、松本晴子、竹原さゆり、石井大佑、下村政嗣、各氏との異分野連携の結果達成できたものである。JST・CRESTおよび新学術領域「生物多様性を規範とする革新的材料技術(24120004)」の支援を受けている。また、本研究を絶え間なく励まし援助し続けてくださっている北大名誉教授の下澤楯夫先生に感謝する。
参考文献
- R.F. Pease, T.L. Hayes, A.S.,Camp and N.M. Amer. “Electron microscopy of living insects.” Science 154, (1966) 1185-1186.
- Y.Takaku, H.Suzuki, I.Ohta, D.Ishii, Y.Muranaka, M.Shimomura, and T.Hariyama. “A thin polymer membrane, nano-suit, enhancing survival across the continuum between air and high vacuum.” PNAS, 110, (2013) 7631-7635.
- I.Ohta, Y.Takaku, H.Suzuki, D.Ishii, Y.Muranaka, M.Shimomura and T.Hariyama, “Dressing living organisms in a thin polymer membrane, NanoSuit, for high vacuum FE-SEM observation.” Microscopy 63, (2014) 295-300.
- Y.Takaku, H.Suzuki, I.Ohta, T.Tsutsui, H.Matsumoto, M.Shimomura and T.Hariyama. “A “NanoSuit” surface shield successfully protects organisms in high vacuum: observations on living organisms in a FE-SEM.” Proc. R.Soc.B 282 (2015) DOI: 10.1098 /rspb. 2014.2857.
- A.Ugolini, A.Cincinelli, T.Martellini and S.Doumett, “Salt concentration and solar orientation in two supralittoral sandhoppers: Talitrus saltator (Montagu) and Talorchestia ugolinii Bellan Santini and Ruffo.” J Comp Physiol A , 201 (2015) 455-460
- H.Suzuki, Y.Takaku, I Ohta, D.Ishii, Y.Muranaka, M.Shimomura and T.Hariyama. “In situ preparation of biomimetic thin films and their surface-shielding effect for organisms in high vacuum”
