電子顕微鏡を用いた生物試料の三次元観察法の比較
日本電子news Vol.50 No.7
春田 知洋
日本電子株式会社 アプリケーション統括室
これまで電子顕微鏡による三次元観察は、透過電子顕微鏡(TEM)によるTEM tomography法によって行われてきた。近年、コンピューター技術と走査電子顕微鏡(SEM)の性能が向上したことにより、SEMを用いたFIB-SEM法、Serial Block-face SEM(SBF-SEM)法、Array tomography法といった三次元観察手法が注目されている。これらの手法は、TEM tomography法と比較すると、観察範囲が広いため生物試料への応用が期待されており、いくつかの成果も挙げている。これらの手法はそれぞれ特徴があるが、同じ試料を用いて、これらの特徴について比較されている例は殆どない。そこで我々は同じ試料をTEM tomography法、FIB-SEM法、SBF-SEM法、Array tomography法を用いて三次元観察を行い、これらの結果を比較することによって、それぞれ手法の利点と欠点、そして適している試料や解析法について考察を行った。
はじめに
組織や細胞の機能や役割を知る上で、細胞を構成するオルガネラやタンパク質複合体の三次元的構造や局在は、重要である。こうした情報は、基礎研究に役立つだけではなく、時に重大な疾病の治療法や薬剤の開発にも役立つ。これまでこれらの微小構造の三次元観察にはTEM tomography法が利用されてきた。TEM tomography法は、薄膜試料の連続傾斜像を撮影し、得られた像を逆投影することによって三次元像を再構成する。この方法では、非常に高い分解能が得られるものの、試料の厚さに‘電子線が透過できる厚さ’という制限が存在する。そのため、この方法を用いて、細胞全体や組織全体の三次元構造解析を行うことは困難である。しかし、近年の組織学や細胞生物学は分子細胞生物学と強く結び付いており、微小構造の形態や分布が、組織や細胞全体に対してどのような影響を及ぼしているかについて明らかにすることが重要視される。そのために、電子顕微鏡の分解能を維持しながら細胞全体や組織全体を観察できる観察手法の開発が進められ、FIB-SEM法、SBF-SEM法、Array tomography法という3種類の三次元観察法が注目されている[1, 2, 3](Fig. 1)。
FIB-SEMは、SEMにFocused ion beam(FIB)鏡筒が取り付けられており、FIBによる加工を行い、加工の結果をSEMで観察をすることができる。FIBは、生物試料の解析では、あまりなじみのない装置であるがダイヤモンドナイフでは切削できない金属や鉱物を扱う材料系の分野において試料の薄膜化やSEM観察用の面だしに利用されている装置である。FIB-SEM法で三次元構造を観察するにはFIBで試料表面を削り、新たに露出した面をSEMで観察をする[1]。この切削と画像取得を繰り返し、得られた連続断面像を積み上げることによって三次元像を再構成する。FIB-SEM法の利点は、高精度で切削位置を決めることができ、さらにウルトラミクロトームで切削するより薄く試料をイオンビームで切削することができることである。また、金属や骨といったダイヤモンドナイフでは薄切できない硬い試料への応用が挙げられる。一方で欠点としては、イオンビームを走査しながら切削を行うので、切削スピードが遅いことと、切削範囲が狭いことである。
SBF-SEM法は、SEMの試料室内にダイヤモンドナイフで試料表面を切削する機構を組み込み、SEMの試料室内で試料表面の切削を行い、新しい切削面をSEMで観察する手法である。FIB-SEMと同様に切削と観察を繰り返し、観察像を積み上げることで三次元像を再構成する[2]。SBF-SEM法の利点は、ダイヤモンドナイフで試料を切削するので切削スピードが速く、一度に切削できる切削面が広いことである。一方で、短所としては、バルク試料の表面を観察するため試料に導電性を持たせる必要があり、また後染色ができない上、もともとコントラストの高い像を得ることができないことを補うために、NCMIR法[3]などを用いた試料固定法を施す必要がある。NCMIR法は、OsO4固定を2度、酢酸ウラニルとアスパラギン酸鉛によるブロック染色を行うなど試料の形態の保存が通常の二重固定法に比べて劣る。また、NCMIR法により導電性を上げた試料とはいえ試料によってはSEM観察のために電子線を照射すると観察試料がチャージすることがあることなどが挙げられる。
最後はArray tomographyである。Array tomography法は連続超薄切片をウルトラミクロトームで作製し、シリコンウェハーなどの導電性のある硬い基板に張り付ける。この連続切片試料を一枚ずつSEMで観察し、順番通りに積み上げることで三次元再構成を行う[4]。Array tomographyの利点は観察試料が、導電性のある硬い基板上の薄膜なのでチャージアップしにくく、後染色できるので形態の保存が良い従来のTEM用に作製した試料をそのまま利用できることと、通常のウルトラミクロトームとSEMがあれば特別な観察装置を必要としないのでイニシャルコストが低く抑えることができることが挙げられる。また他の2種類の方法とは異なり、観察終了後も、観察試料が失われないというのも、この方法の特徴である。一方で短所としては、連続切片作製に習熟した技能が必要であり、 SEMでの観察も長時間になることが挙げられる。
これらの3種の方法の原理は、連続切削面をSEMで観察するとういう点で同じため、手法間での性能や特徴の比較や議論は殆どされてこなかった。そこで本研究では、これら、3種のSEMによる三次元観察法およびTEM tomography法を用いて同じ試料を観察し、得られた三次元像を比較、それぞれの観察手法の特徴について議論する。また得られた三次元再構成像から、宿主の大腸菌の大きさと内包されるファージの数や局在、またファージの種類と局在の関係について解析を行った。
Fig.1 各三次元再構成法の模式図
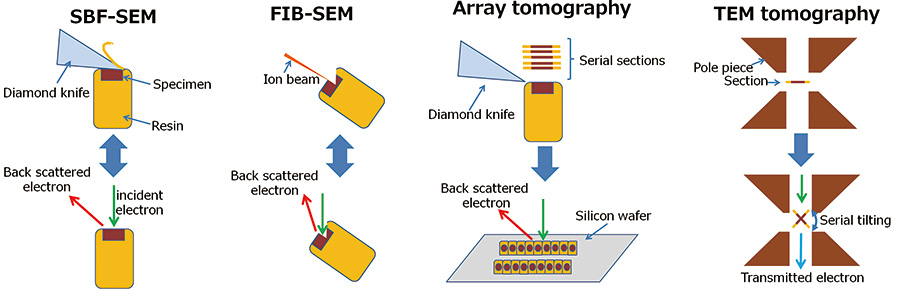
- SBF-SEM:
SEMの試料室内でダイヤモンドナイフによる試料切削と、切削面の反射電子像観察を繰り返すことで、三次元再構成を行う。 - FIB-SEM:
SEMの試料室内で細く絞ったガリウムイオンビームによる試料切削と、切削面の反射電子像観察を繰り返すことで、三次元観察を行う。 - Array tomography:
ウルトラミクロトームにより連続切片を作製し、シリコンウェハー等固い基板に回収する。この連続切片を一枚一枚撮影し、順番通り積み上げることで三次元再構成を行う。 - TEM tomography:
TEMにより連続傾斜投影像を撮影し、これらの傾斜像をCT法により内部構造の三次元再構成を行う。
材料と方法
本研究では、T4ファージ、λファージ、φ174ファージに感染した大腸菌を観察試料とした。ファージは大腸菌に感染するウイルスであり、そのサイズは大きくても200 nm以下と電子顕微鏡でなければ、その形態を観察できない(Fig. 2 a ~ c)。ファージは大腸菌に感染すると自分のDNAやRNAといったゲノムを大腸菌に打ち込み、宿主である大腸菌の転写、翻訳、複製といった機能を乗っ取って、大腸菌内で増殖する。この時、大腸菌の体内では無数のファージの粒子を観察することができる(Fig. 2 d ~ f)。ファージは宿主の体内で十分に増殖すると、宿主を破裂させ、宿主の外へと出ていく。そして、また新たな宿主に感染をするというライフサイクルを持っている。
まず我々は、固い寒天培地の上に、大腸菌を含んだ柔らかい寒天培地を重層し、ファージの溶液を滴下することによって大腸菌にファージに感染させた。その後、大腸菌を培養すると、ファージに感染した領域はプラークとして観察ができる。このプラークの領域を切り出し、ファージに感染した大腸菌を得た。TEM tomography法とArray tomography法のためのサンプルでは、グルタールアルデヒドで前固定後、四酸化オスミウム溶液で後固定した。後固定をしたサンプルはエポキシ樹脂で包埋後、ウルトラミクロトームによって超薄切した。Array tomography法用の連続超薄切片は、シリコンウェハーに回収した。この超薄切した切片を酢酸ウラニルとクエン酸鉛で二重染色し、観察試料とした。FIB-SEM法、SBF-SEM法に用いるサンプルはNCMIR法により、より強い重金属染色を行った[3]。 FIB-SEM法の試料は、試料によっては、通常の二重固定試料を用いることもできるが、今回はよりコントラストの強いNCMIR法を用いた。固定、染色を終えたサンプルは、エポキシ樹脂に包埋し、観察試料とした。観察条件はTable 1に示す。
FIB-SEM法、SBF-SEM法、Array tomography法で得られた連続切片画像はFiji[5]によってアライメント後、Stacker(システムインフロンティア社製)によって三次元再構成を行った。TEM tomographyはTEMography(システムインフロンティア社製)を用いて、連続傾斜像の取得、三次元再構成を行った。得られた三次元像はColorist(システムインフロンティア社製)を用いてセグメンテーション、定量解析を行った。
Fig.2 ファージのTEM観察結果
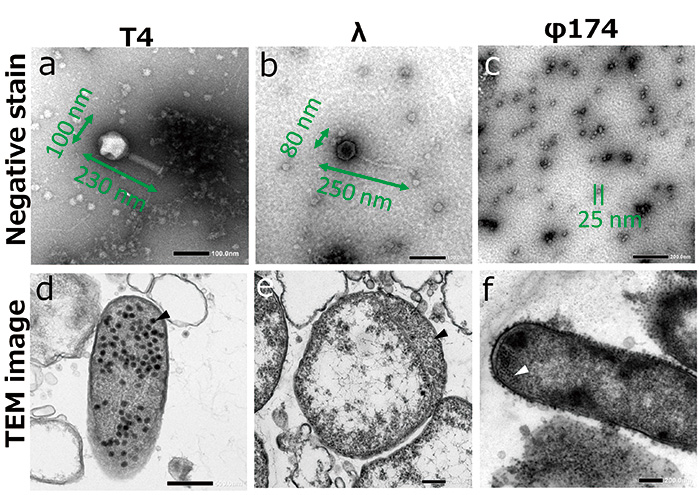
ファージのネガティブ染色像(a~c)と大腸菌内でファージが増殖している様子(d~f、 矢頭)。
Table 1 各種観察法の撮影条件
| SBF-SEM | FIB-SEM | Array tomography | TEM tomography | |
|---|---|---|---|---|
| Instrument | JSM-7800F with Gatan 3View 2XP | JIB-4610F | JSM-7800F | JEM-1400Plus |
| Acquisition area (X,Y) | 24 × 24 μm2 | 18 × 24 μm2 | 19 × 24 μm2 | 3.5 × 3.5 μm2 |
| Acquisition depth (Z) | 7.5 μm (50 nm × 150 image) | 10.8 μm (20 nm × 543 image) | 1.4 μm (70 nm × 20 image) | 200 nm |
| Pixel size (X,Y) | 3 nm | 9.4 nm | 4.7 nm | 1.72 nm |
| Pixel size (Z) | 50 nm | 20 nm | 70 nm | 1.72 nm |
| Numbers of pixels | 8192 × 8192 | 1920 × 2560 | 3840 × 5120 | 2048 × 2048 |
| Accelerating voltage | 1.0 kV | 3.0 kV | 7.0 kV | 120 kV |
| Acquisition time | 2.5 hour | 48 hour | 4 hour | 1 hour |
結果と考察
電子顕微鏡を用いた三次元再構成法の比較
今回の条件で、まずはT4ファージに感染した大腸菌に関して、 SBF-SEM法、FIB-SEM法(それぞれ面出ししたバルク試料表面のSEM像、加速電圧それぞれ1 kVと3 kV)、Array tomography法(シリコンウェハー上の超薄切片試料、加速電圧7 kV)、そしてTEM tomography法(メッシュ上の超薄切片のTEM像、傾斜なし、加速電圧120 kV)によって二次元像を観察した。それぞれを比較すると、バルク表面の観察を行ったSBF-SEM法、FIB-SEM法では超薄切片を観察したArray tomography法、TEM tomography法に比べ、像のシャープさが劣って見えた(Fig. 3)。これは、今回の試料では観察視野の多くを導電性のない樹脂のみの領域が占め、この領域で起きるチャージアップを防ぐため低加速で観察を行ったためである。Array tomography法で撮影された像は、TEM像と同等の像が得られた。これは試料を超薄切片として導電性のあるシリコンウェハーに張り付けたため、同じ試料でもチャージアップが起こらず高い加速電圧で観察できたためだと考えられる。導電性を高くし、高加速電圧で観察することは、SEMを用いた生物試料を三次元観察する上で重要なファクターとなることが解る(Fig. 3 c)。また、SBF-SEM法、FIB-SEM法による観察においても、像質が超薄切片観察に比べて劣るが、大腸菌内に含まれるファージ粒子を見分ける解像度を維持していることが解る。
視野全体を三次元再構成してみると、TEM tomography法では切片の厚さ(200 nm)が大腸菌の厚さ(約2 μm)よりも小さいため、1つの大腸菌の全体像すら、三次元再構成出来ないことが解る(Fig. 4 d)。一方で、SBF-SEM法、FIB-SEM法では大きい体積の領域の三次元観察に成功している(Fig. 4 a、b)。Array tomography法ではXY平面の広さはSBF-SEM法、FIB-SEM法と遜色ない。しかし、本実験では、像質の比較を主としたために、撮影枚数を20枚としたために厚さは薄くなった(Fig. 4 c)。技術を必要とするが多くの連続切片を作製し、撮影時間はかかるものの撮影枚数を増やせば、三次元再構成できる厚さを稼ぐことができるものと思われる。一個体全体の三次元再構成ができた大腸菌のファージ粒子と菌体外膜をセグメンテーションした結果、どの手法を用いても、各手法によって分解能に差はあるが、大腸菌の外形とファージ粒子の分布を観察することができた(Fig. 4 e ~ h)。一方、一つ一つのファージ粒子まで拡大してみると、SBF-SEM法とArray tomography法ではファージ粒子のサイズに対してZの分解能が不足しているため、Z方向に伸びた形となっている(Fig. 4 i、k)。FIB-SEM法では、ファージ粒子の形態は丸く表示されるが、TEM tomography法の結果と比較するとディテールが潰れており厚さ方向の分解能は不足している(Fig. 4 j、l)。このように三次元再構成像を比較すると、大腸菌の形態の定量解析と、大腸菌内のファージの分布を解析するには、SEMを用いた三次元解析法のどの方法を利用してもよいが、ファージなどの微細構造の形態観察には、高い空間分解能を持つTEM tomography法が必要であることが分かる。SBF-SEM法とFIB-SEM法を比較すると、バルクの試料を試料室内で加工し、観察するという点で非常に似た結果が得られた。今回、ほぼ同じ体積をSBF-SEM法とFIB-SEM法で観察したが、データ取得に必要とされた時間はSBF-SEM法で2.5時間、FIB-SEM法で48時間とおよそ20倍の差がある(Table 1)。しかし、ファージ粒子の三次元像を見てわかるようにFIB-SEM法の方がSBF-SEM法よりも高いZ分解能で三次元再構成されている。これは、それぞれ、20 nmと50 nmという切削厚さの違いによるものである。
これらの結果をTable 2にまとめた。SBF-SEM法は像質はその他の方法と比較すると劣っているものの、その観察範囲の広さとそのスループットの速さは他の方法の追随を許さない。この特徴から、 SBF-SEM法では、特に大きなボリュームの三次元再構成が必要となる試料や解析に向いていると考えられる。さらに、チャージの少ない試料では、加速電圧を上げて観察できるため像質も向上できると思われる。試料の例としては、観察視野に樹脂のみの領域を少なくできる大きな組織試料が、解析の例としてはコネクトームのような網羅解析が挙げられる。
FIB-SEM法は、SBF-SEM法よりデータ取得時間は長いものの、 Z分解能が高いことが特徴である。この特徴は、観察範囲を狭めることで、利点のみを強調することができる。つまりFIB-SEM法では小さな組織試料や培養細胞が観察試料として向いている。また分解能が高いことは、定量性も高くなるため、定量解析に親和性が高い。また、骨や金属の試料の切削も可能なため硬組織や金属と組織の接触部などの三次元解析にも応用できると思われる。
Array tomography法は観察後に試料が残るが、観察できる深さを深くするためには連続切片作製技術と長い撮影時間が必要であることが分かる。その結果、広い観察領域の中でレアな現象を詳細に解析する目的に向いている。試料が残るので、再度の観察を行うだけではなく、透明な基板を用いれば光学顕微鏡で観察した同じ場所をSEM観察することができるなど、様々な解析手法や応用も期待できる。また試料が導電性のある基板上の薄膜試料のためチャージ現象が起こりにくく高い加速電圧で観察できるため、導電性が低く、試料の周囲を樹脂に囲まれてしまう浮遊細胞、細菌や胚といった試料の観察にも効果を発揮する。
Fig.3 各手法で撮影した画像の視野範囲と画質の比較
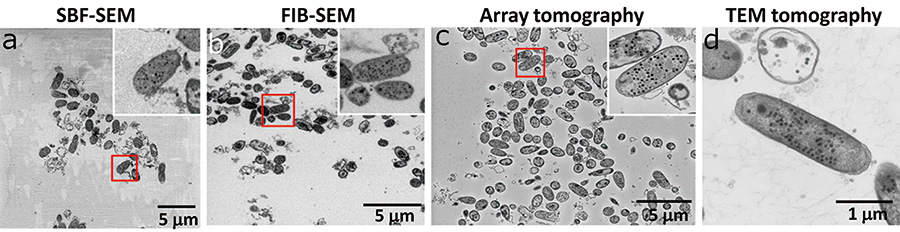
SBF-SEMでは試料ブロックの樹脂の領域が多いため、帯電しやすく、画質の低下を引き起こしている(a)。FIB-SEMもSBF-SEM同様、試料ブロックの樹脂領域を観察することとなるが、切削に用いるガリウムが表面に打ち込まれるため、帯電が押さえられる(b)。Array tomographyでは、試料を薄膜とし導電性の高いシリコンウェハーに回収したため、加速電圧をあげても帯電せず、SN比の高い画像が得られる(c)。TEM tomographyでは一つの大腸菌しか観察できていない(d)。
Fig.4 三次元再構成結果の比較

T4ファージに感染した大腸菌を三次元再構成した。取得した視野全体を用いたボリュームレンダリング像(a~d)。大腸菌(緑)と細胞内で増殖したファージ(オレンジ)と大腸菌に感染、接着しているファージ(ピンク、白矢印)をセグメンテーションした結果(e~h)。一個のファージを抽出した三次元再構成像(i~l)。
Table 2 電子顕微鏡を用いた三次元解析法の特徴のまとめ
| SBF-SEM | FIB-SEM | Array tomography | TEM tomography | |
|---|---|---|---|---|
| field of view (X,Y) | 100 μm over | 1~100 μm | 100 μm | 5 μm less |
| Depth of field of view (Z) | Very deep | Deep | Narrow | Verry narrow |
| 3D resolution (Z) | 50 nm | 20 nm | 70 nm | 1 nm |
| Acquisition time | Some decade ours | Some days | Some days | 1~2 hours |
| effort to acquisition | Little | Little | Enormous | Little |
| Optimal samples | Tissues, Brain | Tissues, Cultured cell | Tissues, Embryo, Cultured cell | Organelle, Virus |
| Optimal application | Conectome, Exhaustive analysis | Morphological observation, Quantitative analysis | Quantitative analysis, CLEM | Morphological observation |
三次元再構成像の解析
①T4ファージに感染した大腸菌の形態と内部のファージ粒子の関係
大腸菌の形態とファージの分布の解析にはSBF-SEMでも十分に行えることが解った。そこでSBF-SEMで得られたデータを用いて、 T4ファージに感染した大腸菌の形態と内包するファージ粒子との関係について解析した。まず大腸菌の体積と内包するファージの数の関係について調べた(Fig. 5 a)。その結果、内包されるファージ粒子の最大は280個前後であり、これ以上多くのファージ粒子を内包する大腸菌は観察できなかった。これは、これ以上ファージ粒子が増えると大腸菌を破裂させてしまうためだと考えられる。また、大腸菌の体積が増えると共に、内包されるファージ粒子の数も増える傾向はあるものの、この大腸菌の体積とファージ粒子の関係は必ずしも直線的な対応はなく、同体積でも内包するファージ数には差があった(Fig. 5 a内のBとC、D、E)。そこで特徴的な個体を抽出した(Fig. 5 a、cのA-E)。抽出した個体は大腸菌の体積が小さく、內包するファージ粒子が少ないもの(Fig. 5 a、cのA、B)、体積は殆ど増えないものの内包されるファージが多いもの(Fig. 5 a、cのC-E)、そして大腸菌の体積も、内包するファージの量も多いものである(Fig. 5 a、cのF)。これらの個体において、ファージ粒子の局在がどのように変化しているか、大腸菌を長軸方向に3等分し、中心部、中間部、両端部の3つに分割し、どの領域にファージ粒子が分布しているか解析を行った(Fig. 5 b)。その結果、内部のファージ粒子が少ない間は、ファージ粒子のその殆どが大腸菌の中央部に分布していた。しかし、内部のファージ粒子が増えるにつれて、中心部に局在していたファージ粒子が中間部から両端部へと分散していく様子が観察される。さらに大腸菌の体積が増加すると、中心部にいたファージ粒子は減り、両端部に分布するファージ粒子は増えていた。大腸菌の形態に注目してみると、内包するファージ粒子が少ない大腸菌は細長い桿状をしているが(Fig. 5 c: B)、内包しているファージ粒子が増えると、短軸方向に膨らみ樽型へと変形していた(Fig. 5 c: C ~ E)。
Fig.5 大腸菌の形態と内包するファージ粒子の関係
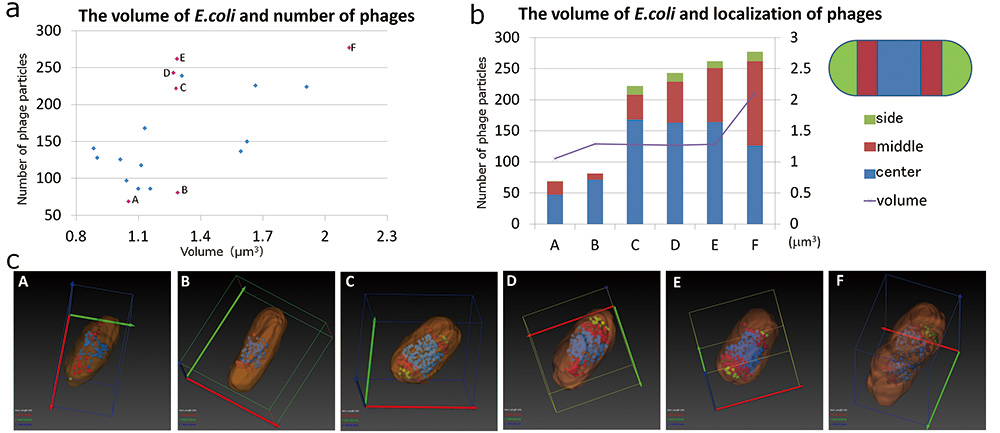
SBF-SEMにより得られたT4ファージに感染した大腸菌のデータから大腸菌の体積と内包するファージの数をグラフ化した(a)。その中で特徴的なもの6個選び(グラフ内ピンクで示す、A~F)、この6個の大腸菌に注目して、体積や内包するファージの数が変化したときの大腸菌の形態とファージの分布について、セグメンテーションによって可視化し(c)、グラフ化した(b)。
②ファージの種類と分布の関係
T4ファージは大腸菌内でも強く染色されるため、すべての三次元再構成法で見分けることができた。しかし、λファージとφ174ファージは大腸菌内でのコントラストが低く細胞成分と見分けることが困難であること、さらにφ174ファージは、サイズも小さいため、像質が高くなければ観察が難しい(Fig. 2 e、c、f)。そこでT4ファージ、λファージ、φ174ファージに感染した大腸菌の比較にはArray tomography法で作製した三次元像を用いて解析した。まずファージに感染した大腸菌の形態に注目してみると、λファージに感染した大腸菌は桿状の形態から球状へと変化していた(Fig. 6 c)。続いて大腸菌を菌体の内部の中心部と細胞壁に近い部分・その中間部分に入れ子状に3分割し、どこにそれぞれのファージが分布しているか調べた(Fig. 6 a)。その結果、T4ファージとφ174ファージは偏りなく大腸菌内に分散していた。しかし、λファージは殆ど大腸菌の細胞壁に近い部分に局在していた。T4ファージ、φ174ファージは溶菌性ファージであり、宿主に感染すると、すぐに宿主内で増殖を始め、宿主の破壊(溶菌)が起きる。一方、λファージは溶原性ファージであり、宿主に感染しゲノムを宿主に打ち込むと、すぐに溶菌化せず、ゲノムを宿主の染色体に組み込み、宿主の一部として振る舞う(溶原化)。しかし、環境の変化によりファージの増殖を抑えるリプレッサーが不活化するとファージの増殖が始まり、宿主は溶菌する。今回、観察される形態変化や局在の差は溶菌化ファージでは打ち込まれたファージゲノムのある場所ですぐさま転写、翻訳、複製が起きているのに対し、溶原化ファージでは宿主のゲノム上で転写、翻訳をしているためかもしれない。またφ174ファージは、菌体の内部を3分割しての分布調査では偏りはなかったが、特定の一部分に局在していることも分かった(Fig. 6 d)。今回の実験では、最初に感染した場所がどこかの特定はできないが、最初に感染した場所と局在している場所に関連があるかもしれない。
Fig.6 大腸菌内のファージの三次元的分布
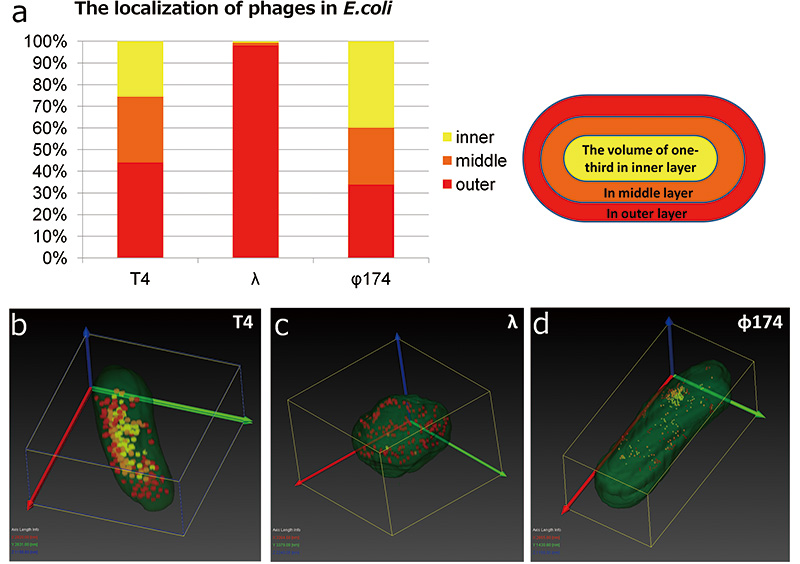
Array tomographyによって得られたT4、λ、φ174ファージに感染した大腸菌のデータから、増殖中のファージの分布を比較した。大腸菌を中心部、中間部、辺縁部(または、inner, middle, outer)に3等分し、各領域に含まれるファージの数を数えた。T4ファージとφ 174ファージは中心部、中間部、辺縁部で大きな偏りはないが、λファージはそのほとんどが外側の層に分布していた(a)。またλファージに感染した大腸菌は、その形態を桿状から球状へと変化していた(c)。
おわりに
同じ原理を用いるSBF-SEM法、FIB-SEM法、Array tomography法による三次元再構成法であるが、用いる試料の種類や、必要な解像度等の撮影装置の条件などから向き、不向きの試料があることが言える。SBF-SEM法やFIB-SEM法ではデータ取得は自動で行われるが、その後の解析は手動で行われる部分が多い。関心のある組織や領域を抽出するセグメンテーションではコントラストを基準として行うことが多いが、生物試料はコントラストの差が小さく、コントラストだけでは決め手にならないことがある。そのため、一枚一枚の撮影画像が高い解像度を保つことは、容易く形態によって見分けることができるため、セグメンテーション作業の効率に深く関わる。
またSBF-SEM法やFIB-SEM法では特別な装置の導入が必要であり、一方Array tomography法では、ウルトラミクロトームとSEMがあれば実験が開始できるが、必要な労力が多くなる。これらのことから、観察したい試料と研究の目的に対して、どの三次元解析法を用いるかという選択は、研究を効率的に進めていく上で重要な戦略となる。本稿が今後、電子顕微鏡を用いて三次元観察を始めようと考えている研究者に対して参考になれば幸いである。
謝辞
本稿は第69回日本細胞生物学会大会、ASCB-EMBO 2017 meetingで発表した内容を改訂したものです。大腸菌、ファージは独立行政法人製品評価技術基盤機構より供与いただきました。また本稿の執筆にさいし、日本電子社員の助力、協力を頂きました(SBF-SEM法の技術指導と議論は山口祐樹、FIB-SEM法によるデータ取得は松島英樹、Array Tomography法のデータ取得は須賀三雄、データ取得後のセグメンテーションは蓮見景子、そして全体の研究の指導、管理は西岡秀夫)。この場を借りて御礼申し上げます。
参考文献
- Knott G, Marchman H, Wall D, Lich B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. (2008).
- Micheva KD, Smith SJ. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. (2007).
- Deerinck, T. J. & Bushong, Eric & Thor, A & Ellisman, Mark. NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. Nat Center Microsc Imag Res. 6-8. (2010).
- Denk W, Horstmann H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biol. (2004).
- Schindelin J, Arganda-Carreras I, Frise E, Kaynig V, Longair M, Pietzsch T, Preibisch S, Rueden C, Saalfeld S, Schmid B, Tinevez JY, White DJ, Hartenstein V, Eliceiri K, Tomancak P, Cardona A. Fiji: an open-source platform for biological-image analysis. Nat Methods. (2012).
