電子イオン化(EI)と光イオン化(PI)を併用したGC×GC-HRTOFMSによる石油試料中のバイオマーカーの分析
日本電子news Vol.50 No.8
生方 正章、上田 祥久
日本電子株式会社 MS事業ユニット
弊社GC-TOFMS(ガスクロマトグラフ飛行時間質量分析計)の最新機種であるJMS-T200GC AccuTOF™ GCx-plusは高い質量分解能を有し、さらに高速で質量スペクトルを取得することが可能なハイエンドGC-MSである。この最新のGC-MSの「光イオン化イオン源」と、GC分離技術の1つであるGC×GC法を組み合わせたシステムを用いて、石油試料中のバイオマーカー分析を行った事例を紹介する。
はじめに
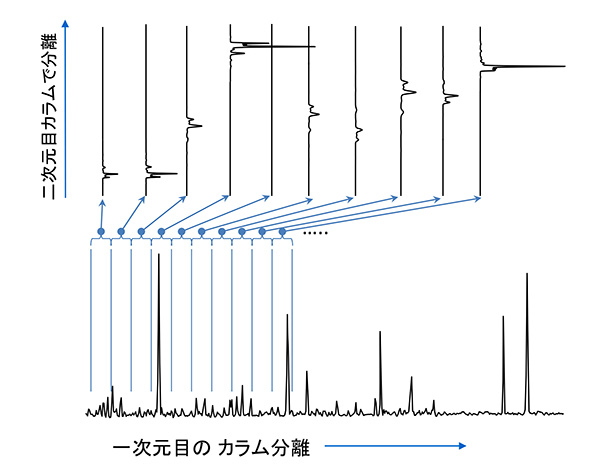
近年、ガスクロマトグラフ(以下、GCと略す)技術、特にキャピラリーカラムに関する技術の進歩により、多種多様な分離能力を有するカラムが開発されている。また、より複雑な成分組成を有する化学物質群の分離分析に対し、高度なキャピラリーカラムの技術を応用したComprehensive two dimensional GC system(以下GC×GCと略す)が開発されている[1, 2]。GC×GCは、直列に接続した分離モードの異なる2種類のキャピラリーカラムと、1段目のカラムと2段目カラムの間に設置されたクライオトラップシステム(モジュレーター)により構成されており、一度の分析で2種類の分離モードでの分離分析を行うことが可能となる。1段目のカラムで分離され溶出した成分は、モジュレーターにより一定の時間(通常は5 ~ 10秒程度)トラップされた後、直ちに2段目のカラムに導入される。2段目のカラムには内径が細く長さの短いカラムが使用され、1段目のカラムからの溶出物がトラップされている間(5 ~ 10秒)の非常に短時間での分離が行われる。つまり、1段目のカラムからの溶出物を5 ~ 10秒のセグメントごとにトラップし、そのトラップした成分を2段目のカラムで分離することになり、結果的に得られるクロマトグラムは通常のクロマトグラムとは異なり2つの時間(溶出時間)軸を持つ二次元的なクロマトグラムとなる。
一般的なGC-MSのMSとしては四重極型MS(以下、QMSと略す)がもっとも広く用いられているがGC×GCの検出器としてのMS を考えた場合、QMS は最適なMSであるとは言い難い。GC×GCシステムでは、2段目のカラムとしては内径が細く長さが短いものを使用しており、2段目カラムでの分離は5 ~ 10秒という短時間で行われるため、得られるクロマトグラムのピーク幅は狭くなる。ピーク幅の狭いクロマトグラムピークに対して充分なデータポイント数を得るためには、検出器として高速なデータ取り込みスピードが要求されることになる。しかしながら、QMSのデータ取り込みスピードには限界があり、GC×GCの検出器としてQMSを用いることは、不可能ではないが二次元目のクロマトグラムのデータポイント数に制限が出てしまうという問題があることから、GC×GCに対する「最適なMS」とは言い難い。
このような背景から、当社では、高い質量分解能を有しながら高速で質量スペクトルを取得可能なガスクロマトグラフ飛行時間質量分析計(以下GC-TOFMS と略す)とGC×GCを組み合わせたGC× GC-TOFMSシステムを構築し、2004年以来、種々の複雑系サンプルの分析にご利用頂いている[3-7]。本稿では弊社GC-TOFMSの最新機種であるJMS-T200GC AccuTOF GCx-plusとそのオプションイオン源である「光イオン化イオン源」、さらにはGC×GCと光イオン化イオン源を組み合わせたシステムを用いて、石油試料中のバイオマーカー分析を行った事例を紹介する。
GC×GC-PI-TOFMSシステム
GC×GCシステム
弊社では、GC×GCシステムとして、米国Zoex社の製品を採用している。2つのカラムの接続部分にはFig. 1に示したような「モジュレーター」が設置されており、1段目のカラムから溶出された成分は一定時間(5 ~ 10秒)モジュレーター部のCold jetによりカラム接続部の一部分にクライオトラップされた後、ほんの短い間のHot jetにより加熱されることにより2段目のカラム内に送りこまれることになる。この動作を一定時間間隔(5 ~ 10秒間)で連続的に行うことにより、Fig. 2に示したようにクロマトグラム分離が二次元的に行われることになる。
Fig.1 GC×GCモジュレーター模式図
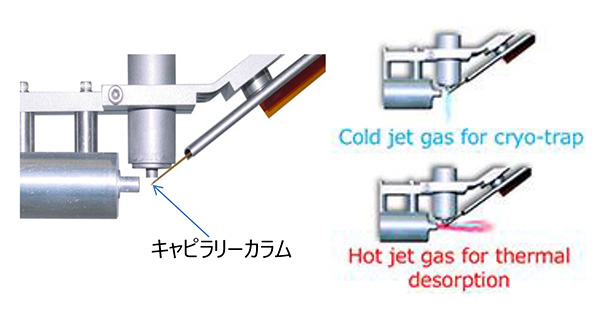
Fig.2 GC×GCで得られる二次元クロマトグラムの概念図
光イオン化イオン源(PI)
GC-MSでもっとも広く使われているイオン化法は電子イオン化(EI)法であるが、このイオン化法ではイオン化エネルギーが高く、フラグメントイオン由来のイオンが多数検出される。フラグメントイオンが得られることは、分析対象化合物の部分構造を得るという目的、もしくはマススペクトルのパターンからライブラリーサーチによる化合物同定を行う目的では有用である一方、分析対象化合物の分子量情報や、分子全体の元素組成情報を得るという観点では、分子イオンを得にくいため、理想的なイオン化法とはいえない。この様に高いイオン化エネルギーを用いるイオン化法を「ハードイオン化法」と呼ぶのに対し、エネルギーの低い状態で分析対象物質をイオン化する方法は「ソフトイオン化法」と呼ばれる。GC-MSの分野で利用されるソフトイオン化法としては「化学イオン化(CI)法」が一般的であるが、弊社ではCI法に加え、真空紫外(VUV)光を用いて分析対象物質をイオン化する「光イオン化(PI)イオン源」を開発し、GC-TOFMS (JMS-T200GC)、もしくはGC-QMS(JMS-Q1500GC)のオプションイオン源として販売している。
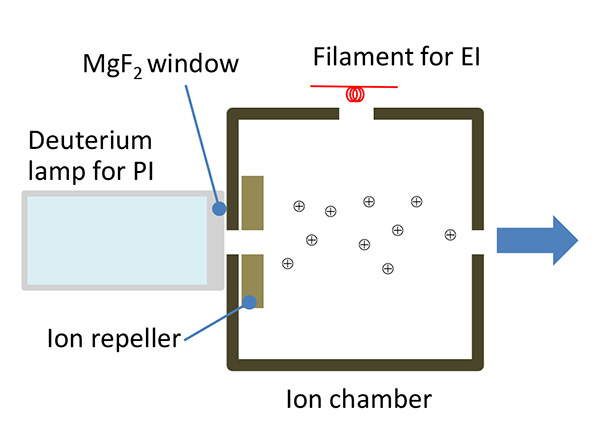
このPIイオン源には、放射光波長が115 ~ 400 nmの重水素ランプが光源として使用されている。本光源ランプの低波長115 nmでのエネルギーは10.8 eVであり、一般的な有機化合物の第一次イオン化エネルギーが10 eV付近であることから、本PIイオン源でのイオン化は、EIイオン化に比べると非常にソフトな(エネルギーの低い)イオン化であると言える。
また、本PIイオン源はその模式図をFig. 3に示したとおり、EIイオン化用のフィラメントも搭載されており、VUV光をOFFにし、フィラメントをONにすることによりEIイオン源としても利用できる。よって、ユーザーは、イオン源周りのハードウェアを変更することなしにEIイオン化とPIイオン化を逐次切り替えることが可能となっている。
Fig.3 PIイオン源模式図
高分解能TOFMSシステム
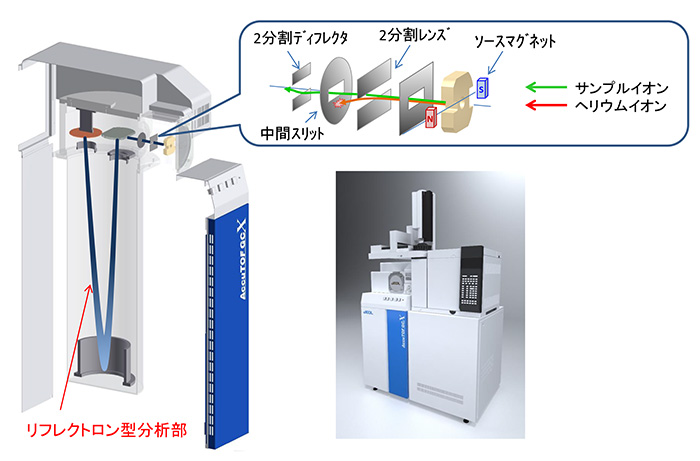
JEOL社製AccuTOF™ GCシリーズの概観、及びイオン源、イオン輸送系及びイオン光学系の模式図をFig. 4に示した。
イオン源とイオン輸送部の役割は、GCから導入されるサンプルをイオン化し、30 eV前後という低運動エネルギーで分析部に輸送することである。
GC-MSでは、GCのキャリアガスとしてヘリウムガスが用いられ、その量は目的化学物質に比べるとはるかに大量である。EI法ではこれらヘリウムもイオン源でイオン化され、サンプルと同様に分析部へと輸送される。また、これらヘリウムに起因するイオン量は圧倒的に多いため周辺部位へのチャージアップを含む大きな空間電荷効果を及ぼし、分解能低下など実際の測定に対して悪影響を及ぼす原因となる。また分析部に導入されたイオンは全て検出器まで到達するという飛行時間型質量分析計の特性から、分析部へのヘリウムイオンの大量導入は、検出器の急激な劣化につながる。このため本装置では、イオン源内にあるソースマグネットやイオン輸送系のレンズ電圧のバランスを調整することにより、イオン源でイオン化されたヘリウムイオンの99.9%以上を排除するイオン輸送系を実現した。また、本装置の分析部には1段式リフレクトロンを備えており、イオン輸送部から導入されたイオンは、イオンの輸送方向に対して垂直方向に加速されリフレクトロン内を飛行させる構造をとっており、垂直加速飛行時間型質量分析計(oa-TOFMS)となっている。
Fig.4 JMS-T200GCの各部模式図
GC×GC-PI-TOFMSを用いた石油試料中のバイオマーカーの分析
石油探鉱の一つの指標として、原油やその根源岩に含まれているバイオマーカーの分析が行われている。バイオマーカーは石油の起源となった生物に特異的な有機化合物であり、原油内に含まれているバイオマーカーを特定することにより、石油を生成した根源岩の起源となっている有機物の種類や堆積環境、熟成度などの情報が得られると言われている。しかしながら、石油試料はおびただしい種類の炭化水素の集合体であり、またバイオマーカーとされている物質も特定の構造を有する炭化水素であることから、石油試料の中に含まれるバイオマーカーを網羅的に検出することは非常に困難な作業となる。
そこで本報告では、GC×GCの高い分離分析能と、PIイオン化による炭化水素、特に芳香族炭化水素に対するソフトなイオン化法、さらには、TOFMSによる高い質量分解能を組み合わせることにより、石油試料中のバイオマーカーの網羅的検出を試みたので、その分析例を紹介する。
測定条件
詳細な測定条件をTable 1にまとめた。今回用いたGC×GCシステムは「Zoex社製、Zoex ZX2」であり、1段目のカラムには微極性カラムであるBPX5(SGE社製、長さ30 m、内径0.25 mm、液相厚0.25 μm)を用い、2段目のカラムとしては極性カラムであるBPX50(SGE社製、長さ3 m、内径0.1 mm、液相厚0.1 μm)を用いた。このように微極性カラムと極性カラムを組み合わせて用いた。テストサンプルは原油留分Aと原油留分Bの2種類とし、それぞれに含まれているバイオマーカーの量を比較した。
Table 1 測定条件
| Instrument | 日本電子株式会社 AccuTOF™ GCシリーズ |
|---|---|
| Zoex ZX2 thermal modulator | |
| 1st Column | BPX5, 30 m × 0.25 mm, 0.25 μm |
| 2nd Column | BPX50, 3 m × 0.1 mm, 0.1 μm |
| Modulator period | 6 sec |
| Inlet pressure | 350 kPa (Out flow : 1.75 mL / min) |
| Inlet mode | Cool on column, Oven track mode, 1 μL Injection |
| Oven Temp. | 50°C (2 min) → 10°C/min → 250°C |
| Ion Source | EI/PI Combination Ion Source |
| Ionization mode | PI+ (D2 lamp, 115~400 nm) |
| m/z range | m/z 35~700 |
| Spectrum recording speed | 25 spectra / sec |
測定結果
Fig. 5には、代表的なバイオマーカーであるCholestane、及びAdamantaneをPI法で測定した際に得られるマススペクトルを示した。いずれの化合物においても、分子イオンに由来するM+イオンがベースピークとして検出され、これらの物質の分子イオンの観測にPI法が有用であることがわかった。
次にFig. 6及びFig. 7に2種類の原油サンプルのGC×GC/PIでの二次元TICクロマトグラムを示した。いずれのサンプルからも一連のn-Alane類(CnH2n+2)やCycloalkane類(CnH2n+1)が観測されているのと同時に、いずれのサンプルからも、2段目のカラムのリテンションタイムの遅い側に多数の化合物が検出されている。いくつかのピークから、PIにより得られたスペクトルを解析することにより、これらの化合物はn-Alkane類やCycloalkane類よりも不飽和度の高い、CnH2n-4やCnH2n-6、CnH2n-8であることがわかった。同じ2種類の原油留分試料を、まったく同じGC×GC条件でEIイオン化を用いて測定を行い、これらのCnH2n-4、CnH2n-6、CnH2n-8に相当するピークのEI マススペクトルによるライブラリーサーチの結果からこれらの化合物が、原油留分AではCholestaneに代表される多環系飽和炭化水素類であり、原油留分BではAdamanteneに代表される飽和の橋かけ環状炭化水素類であることがわかった。
そこで、バイオマーカーとして一般的に知られているTable 2に示した6つの化合物に関して、PI法による測定結果から、その分子イオンを基にしたm/z を用いて高質量分解能状態での二次元EIC(Extracted Ion Chromatogram)を作成したところ、Fig. 8及びFig. 9に示したように、原油留分Aからは、18-Norabietane、 Cholestane、Hopaneが、原油留分BからはAdamantane、Iceane、 Diamantaneが特異的に含まれていることがわかった。そこで、それぞれのバイオマーカーの類縁化合物の存在を系統的に評価するため、異なる炭素数におけるCnH2n-4やCnH2n-6、CnH2n-8に相当する高質量分解能二次元EICの合算クロマトグラムを作成した。各々の合算二次元EICをFig. 10及び Fig. 11に示した。
その結果、前述したバイオマーカーの類縁化合物が、それぞれの炭素数の違いにより、各々の原油留分に含まれていることを明確に見出すことができた。PI法では、それぞれのバイオマーカーの類縁化合物についても、選択的に分子イオンを観測することができるため、GC×GCの高分離能と組み合わせることにより、バイオマーカーの存在量を系統的に評価することが可能となった。
また、今回測定を行った原油の異なる留分において、PI法とGC× GCを組み合わせた測定結果により、各々に含まれているバイオマーカーの違いがあることが見出された。
Fig.5 Cholestane及びAdamantaneのPIマススペクトル
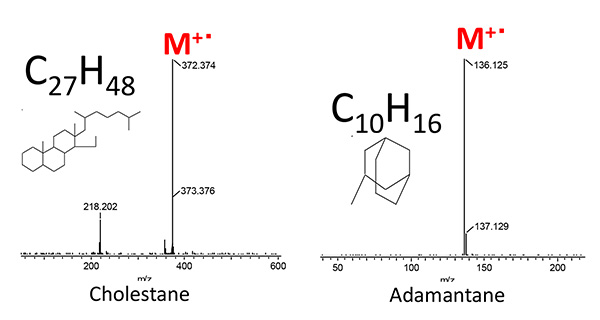
Fig.6 原油留分AのGC×GC/PIの二次元TIC
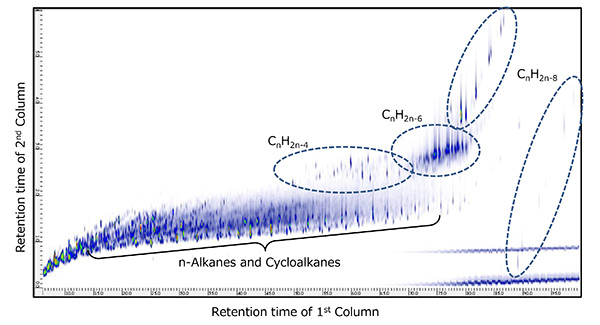
Fig.7 原油留分BのGC×GC/PIの二次元TIC
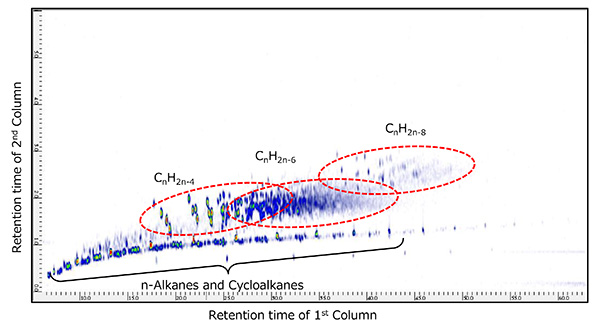
Fig.8 原油留分AのGC×GC/PI二次元EIC
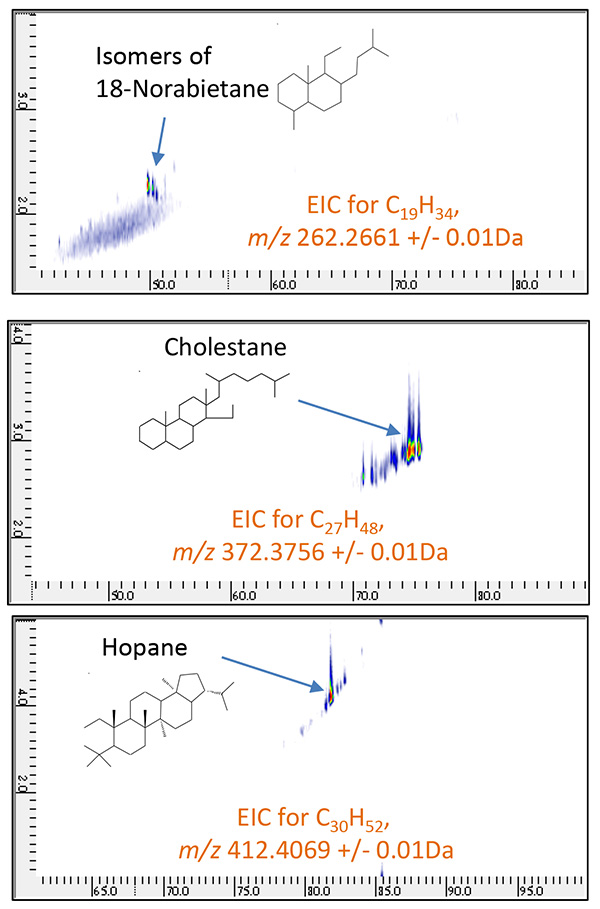
( m/z 262.2661, 372.3756, 412.4069 )
Fig.9 原油留分BのGC×GC/PI二次元EIC
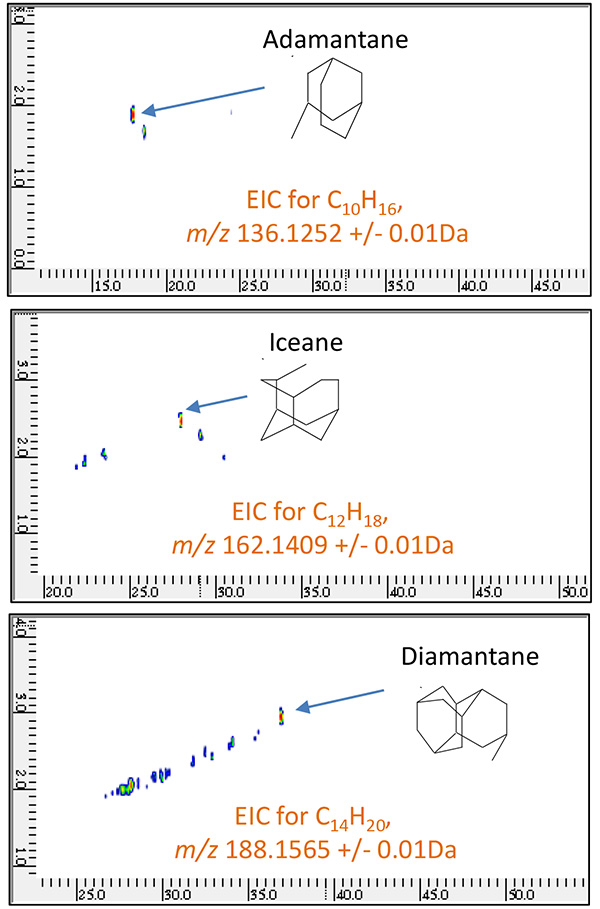
( m/z 136.1252, 162.1409, 188.1565 )
Fig.10 原油留分AのGC×GC/PI合算二次元EIC
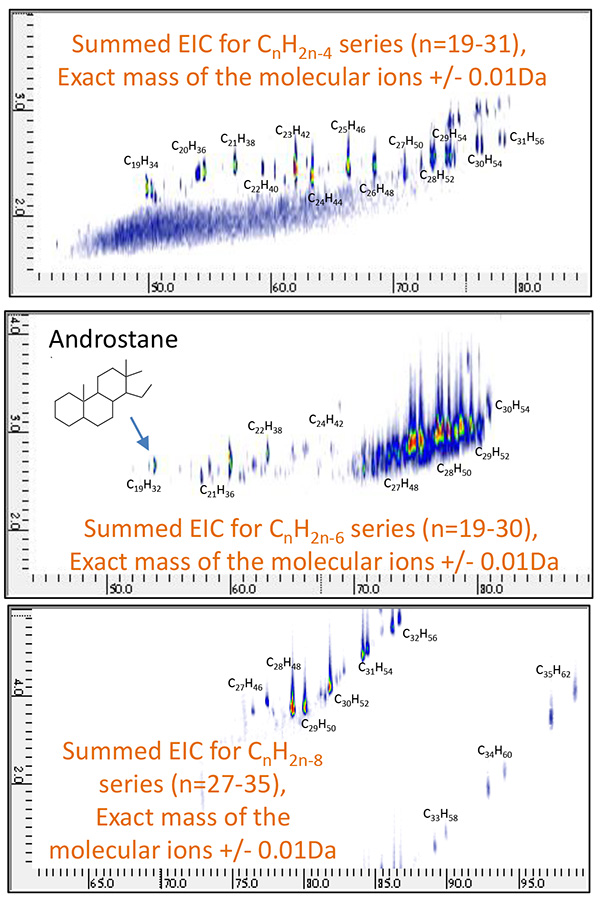
( CnH2n-4 : n=19~31, CnH2n-6 : n=19~31, CnH2n-8 : n=27~35 )
Fig.11 原油留分BのGC×GC/PI合算二次元EIC
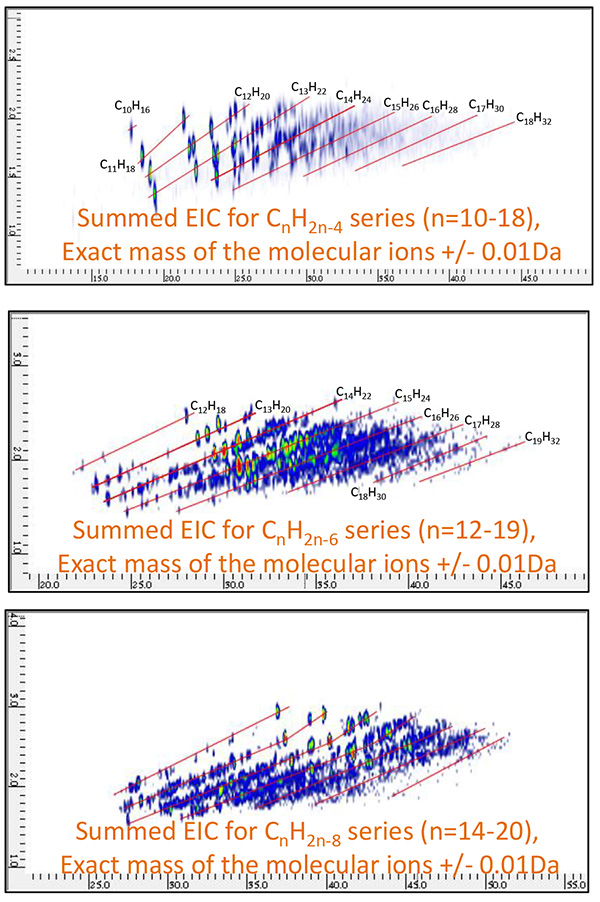
( CnH2n-4 : n=10~18, CnH2n-6 : n=12~19, CnH2n-8 : n=14~20 )
Table 2 代表的なバイオマーカーとその分子イオンのm/z
| Compounds | Rational Formula | m/z |
|---|---|---|
| 18-Norabietane | C19H34 | 262.2661 |
| Cholestane | C27H48 | 373.3756 |
| Hopane | C30H52 | 412.4069 |
| Adamantane | C10H16 | 136.1252 |
| Iceane | C12H18 | 162.1409 |
| Diamantane | C14H20 | 188.1565 |
まとめ
GC×GCは高度なGC技術であり、そのクロマトグラム分離能はこれまでのGC分離に比較して飛躍的に高いといえる。しかしながらそのGC×GCの分離分析能を最大限に引き出すためには、高質量分解能状態で高速にマススペクトルの収集が可能なTOFMSや、複数の視点からマススペクトル得る手段、具体的にはハードイオン化法とソフトイオン化法を組み合わせた形での分析が有用であるといえる。このことから、GC×GCと、炭化水素化合物の分子イオンを検出することができるPIイオン源、さらには高質量分解能状態で、非常に高速にマススペクトルを取得できるAccuTOF™ GCシリーズを組み合わせたGC×GC-PI-TOFMSシステムは、石油試料中のバイオマーカーのような複雑な混合物の分析には非常に強力なツールといえる。
参考文献
- Z. Liu, J. B. Phillips, J. Chromatogr. Sci., 29 227(1991).
- J. C. Giddings, Anal. Chem., 56 1258A(1984).
- ゲステル株式会社、落合伸夫、「GC×GC−TOFMSによる環境汚染物質の超微量分析」、JEOL MS ユーザーズミーティング(2008).
- S. Hashimoto, Y. Takazawa, A. Fushimi, H. Ito, K.Tanabe, Y. shibata, M. Ubukata, A. Kusai, K. Tanaka, H. Otsuka, K. Anezaki, J. Chromatogr. A., 1178 187(2008).
- 一般社団法人九州環境管理協会、上田守男、「GC×GC-HRTOFMSを用いた燃料油中の有機化合物の定性および定量」、JEOL MS ユーザーズミーティング(2010).
- 日本電子ニュース、Vol. 44(2017), p40 ~ 49.
- Anupam Giri, et al., Anal. Chem., 89(10)(2017), p5395-5403.
