次世代200 kVクライオTEMの紹介
日本電子news Vol.49 No.4
細木 直樹
日本電子株式会社 EM事業ユニット
近年クライオ透過電子顕微鏡(TEM)法において高分解能での解析結果が次々と報告されている。そこでJEOLは高効率、高操作性、高分解能化の実現を目指した次世代クライオTEMを開発した。本稿ではこの次世代クライオTEMについて紹介を行う。
はじめに
Fig. 1

新型クライオTEM"CRYO ARM™"の外観図
クライオTEM法は精製したタンパク質やウイルス、細胞といった試料を急速凍結することで、溶液中の分子形態を保ったまま試料の観察を行うことができる手法である。近年、クライオTEM法は単粒子解析法や電子線トモグラフィ法と言った三次元再構成法と組み合わされることにより脚光を浴びている [1]。その背景には電子線直接露光検出器の登場による取得画像の高分解能化やTEMのオートメーション機能の拡充によるスループットの上昇等が挙げられる。特に単粒子解析法の発展は著しく、近原子分解能といった高分解能でのタンパク質構造解析結果が次々と報告されており、解析結果の創薬分野への寄与が期待されている[2]。
JEOLは高いスループットおよび操作性を持ち、より高い分解能での構造解析が可能となるクライオTEMの開発を行った。本装置はJEM-ARM200Fをベースとして開発され、愛称を"CRYO ARM™" とした(Fig. 1)。電子銃は加速電圧の200 kVの電界放出型電子銃(FEG)である。その他、専用のクライオステージ、多試料自動搬送機構、液体窒素自動充填機構、自動画像取得ソフト、オメガフィルタ、位相板といった特徴を備えている。各特徴について、これより詳細を述べていく。
電子銃
まず電子銃についてであるが、本装置は冷陰極電界放出型(CFEG)とショットキー型(TFEG)のどちらかを選択できる。
CFEGの放出電子のエネルギー幅はTFEGの約50%(Fig. 2)、光源サイズは~ 10 nmでTFEGの約10分の1であるので干渉性が高く、色収差の影響が少ない像が得られる。そのため、主として位相コントラストを観察するクライオTEMでは、像コントラストの向上が望め、低い電子照射密度で得られた像の分解能が向上する可能性がある。実際にそれぞれの電子銃を用いて、標準試料であるプラチナイリジウムを観察した。クライオTEM 観察時のように-1000 nmという高いデフォーカスを掛けた場合、CFEGの方がより微細な格子縞を観察することができた(Fig. 3)。それぞれの画像をフーリエ変換したところ、TFEGでは0.19 nmのピークが観察されたのに対して、CFEGでは0.14 nmのピークまで観察することができた(Fig. 3)。
Fig. 2
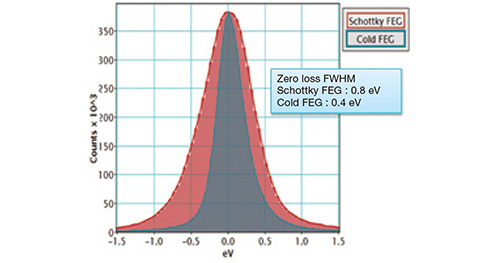
各電子銃のエネルギー分解能。冷陰極電界放出型(青)およびショットキー型(赤)電子銃で得たゼロロススペクトルで、半値幅はそれぞれ0.4 eV、0.8 eVである。
Fig. 3

冷陰極電界放出型(A)およびショットキー型(B)電子銃を用いて観察したプラチナイリジウム。それぞれ-1 μm程度のデフォーカスを掛けて画像取得を行った。右上のインセットはそれぞれの画像のフーリエ変換像。
クライオステージおよびクライオポールピース
本装置は液体窒素冷却の専用クライオステージを実装しており、 100 K以下という極低温での試料観察を行うことができ、アイスコンタミネーションを軽減する工夫も為されているため、長時間の観察も行うことができる。また、本ステージに位置するポールピースは高分解能タイプと高傾斜タイプのどちらかを選択できる。それぞれのポールピースの保証分解能は、高分解能タイプが粒子像0.25 nm、格子像0.2 nmで、高傾斜タイプが粒子像0.30 nm、格子像0.2 nmである。それぞれのポールピースの傾斜角は高分解能タイプが±10°で、高傾斜タイプが±70°である。高傾斜タイプを選んだ場合、試料の面内回転(0°⇔90°)ができるので二軸傾斜トモグラフィを行うこともできる。
CryoSPECPORTER™
先述のクライオステージには多試料自動搬送機構(CryoSPECPORTER™)が装着され、試料の交換を自動で行うことが可能である。CryoSPECPORTER™は最大12個の専用試料カートリッジを保持することができ、任意の試料を自動でクライオステージに搬送することができる(Fig. 4)。作製した試料グリッドのカートリッジへの装填は専用のクライオワークステーションにて液体窒素環境下で行うことができる(Fig. 4A)。また、カートリッジのCryoSPECPORTER™への搬送は専用のトランスファカップを用いて行う(Fig. 4A)。搬送できる試料は一度に最大4個で、任意の試料の出し入れをGUI上から行うことができるため、本装置を用いて試料のスクリーニングを行うこともできる。CryoSPECPORTER™部分も液体窒素を用いて冷却しているので、105 K以下の温度で長時間の試料保管が可能である。加えて鏡体、CryoSPECPORTER™部分はターボ分子ポンプ、電子銃部分はスパッタイオンポンプで排気されており、オイルフリーでクリーンな排気系を実現している。
Fig. 4
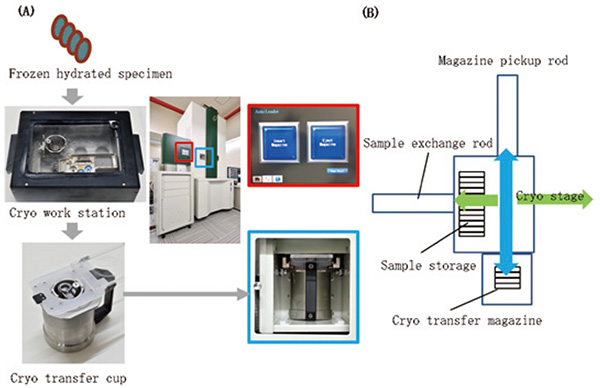
凍結試料の"CRYO ARM™"への搬送。(A)クライオワークステーション内にて凍結試料のカートリッジへの装填、カートリッジのマガジンへの装填が液体窒素温度下にて行われる。試料カートリッジが装填されたマガジンはクライオトランスファカップにて"CryoSPECPORTER™"へ搬送される(青枠)。その後の操作は脇のタッチパネル上にて行う事ができる(赤枠)。(B)"CryoSPECPORTER™"の概念図。クライオトランスファカップにて搬送されたマガジンはMagazine pickup rodにて"CryoSPECPORTER™"内に運ばれる。各試料を保持したカートリッジはSample exchange rodにてマガジンからSample storageに装填される。その後、ユーザーの指定したカートリッジがSample exchange rodによりクライオステージに搬送される。
各種オートメーション機能
その他、本装置は液体窒素自動充填機構、自動平行照射機能、自動画像取得ソフト(JEOL Automated Data Acquisition System: JADAS)といった各種オートメーション機能が実装され、スループットの大幅な向上が図られている。液体窒素自動充填機構により、外部に接続された液体窒素タンクから、任意の窒素残量や時間においてクライオステージおよびCryoSPECPORTER™への液体窒素充填が自動で行われる。100 Lの液体窒素タンクを使用した場合、約一週間の間自動供給を行うことができる。
JADASは単粒子解析用に開発された自動画像取得ソフトである。基本操作は5つのボタンで行うので(Fig. 5A)、初心者のユーザーから扱うことができる。また、TEMのアラインメント操作もGUI上から行うことができる(Fig. 5A)。基本的な撮影の流れは、まず低倍モードで試料グリッドの全体像を撮影する。そこからグリッドメッシュを検出する。その後検出した各グリッドに移動し、低倍像(サーチ画像)を取得して支持膜上の孔を検出する。次に支持膜上でオートフォーカスを行った後、各孔において単粒子解析用の画像を取得するというものである。本ソフトではいくつかの撮影手法をレシピとして用意しているので多様なニーズに応じたデータ取得を行うことができる。例えば、Normalレシピは各サーチ画像において一度オートフォーカスを行い、その後サーチ画像内のすべての孔の画像を取得していく (Fig. 5B)。対してCarefulレシピは検出したすべての孔近傍においてオートフォーカスを行う(Fig. 5B)。また、Semi-autoレシピはユーザーが指定した任意の点においてオートフォーカスと画像取得を行う (Fig. 5B)。
Fig. 5
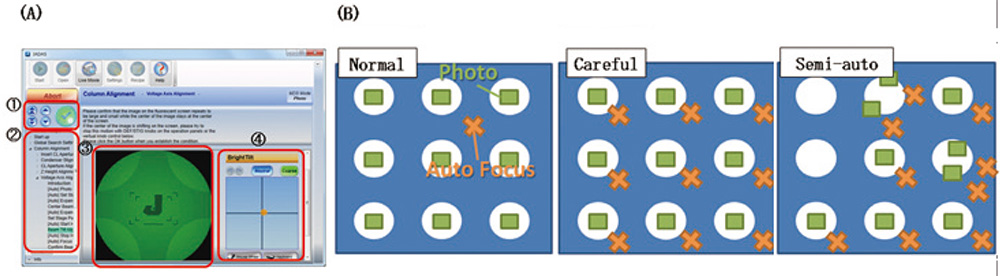
JADASの概略。(A)JADASのGUI。基本操作は赤枠①の5つのボタンを用いて、赤枠②のフローに沿って行う。赤枠③には現在行うべき事がアニメーション等を用いて示される。赤枠④部分において各種デフレクターを調節する事ができる。(B)JADASの代表的レシピの概念図。青い部分は支持膜、緑の部分は画像取得領域、赤い部分はオートフォーカス領域を示す。Normalレシピはサーチ画像において一度のみオートフォーカスを行い、サーチ画像内のすべての孔の画像を取得する。Carefulレシピはサーチ画像内で検出した全ての孔近傍においてオートフォーカスを行う。Semi-autoレシピはユーザーが指定した任意の点においてオートフォーカスを行い、画像取得を行う。
オメガフィルタおよび位相板
上でも述べたがクライオTEM法で観察する試料は軽元素から構成されているので、主として位相コントラストを観察することになる。そのため通常の観察手法を用いると大変低い像コントラストしか得られない。本装置ではオメガフィルタに加え、ゼルニケタイプおよび孔無し(Hole-free)タイプの二種の位相板を装着することも可能であり、高コントラストでのクライオTEM観察を行うことができる。
オメガフィルタはインカラム型のエネルギーフィルタで、分光したスペクトルのうちエネルギー損失スペクトルをスリットでカットし、ゼロロス電子を用いて結像された像は ノイズが減少した高いコントラストの像となる(Fig. 6)。
対して位相板は対物レンズの後焦点面に設置することで、透過波の位相変化が強度情報へと変換されるため、正焦点においても高コントラストの像を得ることができる(Fig. 7)。ゼルニケ、孔無しどちらの位相板も非晶質炭素薄膜でできており、200 °C程度で加熱して使用する。ゼルニケ位相板は直径1 μm以下の中心孔を持つ薄膜であり、これによりコントラストが大幅に改善するが、試料周辺に特有のフリンジを生じる(Fig. 7B)[3]。孔無し位相板では、位相板上に形成される電子線のクロスオーバにより局所的な帯電部分が生じ、そこを通過する電子波の位相が変化することで、ゼルニケ位相板と同等の効果が得られると考えられている[4]。この局所的な帯電部分はゼルニケ位相板の孔径より遥かに小さいため、上に述べたフリンジを軽減させることができる(Fig. 7C)。
Fig. 6
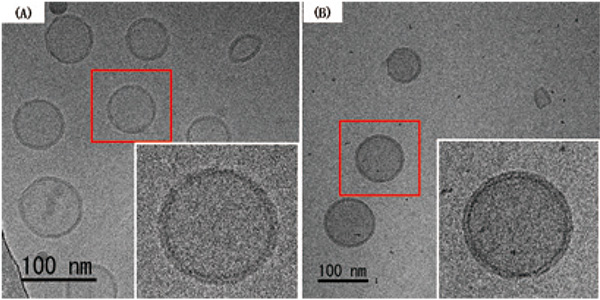
オメガフィルタを用いて取得した氷包埋したリポソームの通常像(A)およびゼロロス像(B)。右下のインセットは赤枠内の拡大図。取得装置はJEM-2200FSで、それぞれ-2 μm程度のデフォーカスを掛けて画像取得を行った。スリット幅は20 eV、照射電子線量は20e-/Å2程度。
Fig. 7
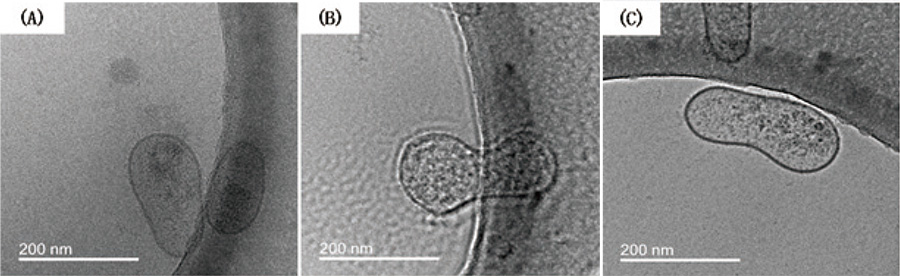
位相板を用いて取得した氷包埋したエクソソームのゼロロス像(A)、ゼルニケ位相差像(B)、孔無し位相差像(C)。取得装置はJEM-2200FSでゼロロス像は-2 μm程度のデフォーカスを掛け、各位相差は正焦点付近で画像取得を行った。スリット幅は20 eV、照射電子線量は20e-/Å2程度。東京大学大学院医学系研究科(国立がん研究センター研究所・分子細胞治療研究分野所属)富永直臣様から試料をご提供頂いた。
おわりに
本装置は大阪大学大学院生命機能研究科プロトニックナノマシン研究室に納入され、現在稼動している。TFEG、高分解能クライオポールピース、クライオステージ、CryoSPECPORTER™、オメガフィルタ、 JADASが構成されている。 加藤らは本装置を用いてβ-galactosidaseの単粒子解析を行ったところ、3.3 Åという高い分解能での構造解析結果が得られた[5]。この結果は200 kVクラスのTEMとしては最高レベルの結果である(https://www.ebi.ac.uk/pdbe/emdb/statistics_volt_source.html/)が、データ取得は15時間程度、データ解析は3日程度という短期間で行われた。
近年著しい発展を遂げるクライオTEM分野において、より高いスループットおよび操作性、高分解能化を実現すべく、様々な特徴を持った新型クライオTEM(CRYO ARM™)の開発を行った。本装置は今後構造生物学をはじめとする様々な分野において寄与する事が期待される。
謝辞
本装置を開発された金子武司、湯浅修一、樋山公崇、藤本直樹、千代出、鴨下明人、石川勇、大藏善博およびプロジェクトメンバーに謝意を表する。
参考文献
- Callway, E. The revolution will not be crystallized. Nature, 525, 172-174(2015).
- Merk A., Bartesaghi A., Banerjee S., Falconieri V., Rao P., Davis M.I., Pragani R., Boxer M.B., Earl L.A., Milne J.L., Subramaniam S. Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell, 165, 1698-1707(2016).
- Hosogi N., Shigematsu H., Terashima H., Homma M., Nagayama K. Zernike phase contrast cryo-electron tomography of sodium-driven flagellar hook-basal bodies from Vibrio alginolyticus. J. Struct. Biol., 173, 67-76 (2011).
- Malac M., Beleggia M., Kawasaki M., Li P., Egerton R. F., Convenient contrast enhancement by a hole-free phase plate. Ultramicroscopy, 118, 77‒89(2012).
- Kato T., Hosogi N., Kaneko T., Ishikawa I., Namba K., Performance of State-of-the-art CryoEM, named "CRYO ARM™". SEIBUTSU BUTSURI, 56, S121(2016).
