ナノ結晶から水素結合を可視化 −低分子医薬品の開発促進や品質向上に期待−
公開日: 2019/08/06
理化学研究所
京都大学iCeMS (物質−細胞統合システム拠点)
日本電子株式会社
理化学研究所 (理研) 科技ハブ連携本部バトンゾーン研究推進プログラム理研-JEOL連携センター[1]ナノ結晶解析連携ユニットの西山裕介ユニットリーダー (放射光科学研究センター NMR応用・利用グループ 副グループディレクター・株式会社JEOL RESONANCE 技術部 エキスパート)、放射光科学研究センター次世代NMR装置開発チームの山崎俊夫チームリーダー、生体機構研究グループの米倉功治グループディレクター、京都大学iCeMS、日本電子株式会社らの共同研究グループ※は、100ナノメートル (nm、1nmは10億分の1メートル) ~1マイクロメートル (μm、1μmは100万分の1メートル) の大きさの微結晶を用いて、低分子有機化合物の水素原子の位置も含めた結晶構造を詳細に観測する手法を開発しました。
本研究成果は、生活習慣病や花粉症などの低分子医薬品の開発促進や品質向上に貢献すると期待できます。
結晶構造解析法の単結晶X線回折[2]では、10μm以上の単結晶が必要であり、製剤に含まれる低分子有効成分の微結晶 (0.1~1μm程度) からは構造解析ができませんでした。
今回、共同研究グループは、電子回折[3]による全体構造解析と固体核磁気共鳴(固体NMR)[4]による局所構造解析を、第一原理量子化学計算[5]を用いて統合することで、0.1~1μmの微結晶から精密な構造解析ができる手法を開発しました。この手法では、一般の製剤に見られるような混ざり物があっても解析ができ、これまで構造が未知であった医薬品シメチジン[6](結晶形B)の構造解析にも成功しました。
本研究は、英国のオンライン科学雑誌『Nature Communications』(8月6日付け:日本時間8月6日)に掲載されます。
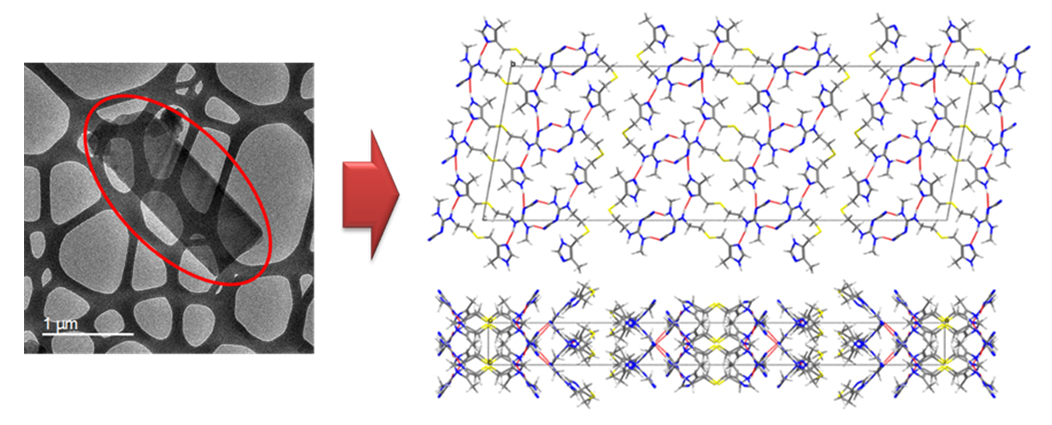
図 シメチジン結晶形Bの微結晶(左:赤丸内)から原子レベルの構造を解明
※共同研究グループ
理化学研究所- 科技ハブ連携本部 バトンゾーン研究推進プログラム 理研-JEOL連携センター
ナノ結晶解析連携ユニット
ユニットリーダー 西山 裕介 (にしやま ゆうすけ)
(放射光科学研究センター NMR研究開発部門 NMR応用・利用グループ 副グループディレクター・株式会社JEOL RESONANCE 技術部 エキスパート) - 研究員(研究当時)カンデラリア・グズマン-アフォンソ (Candelaria Guzmán-Afonso)
客員研究員 ユリ・ホン (You-lee Hong)
(京都大学iCeMS 特定研究員)
特別研究員 (研究当時) アンリ・コロ (Henri Colaux) - 放射光科学研究センター
NMR研究開発部門 NMR開発グループ
次世代NMR装置開発チーム
チームリーダー 山崎 俊夫 (やまざき としお)
利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治 (よねくら こうじ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 理研-JEOL連携センター 次世代電子顕微鏡開発連携ユニット ユニットリーダー)
- EM第1技術開発部 第1グループ
主事 飯島 寛文 (いいじま ひろふみ) - EM第1技術開発部 第2グループ
グループ長 齊藤 晃宏 (さいとう あきひろ) - EMアプリケーション部 Biologyグループ 第2チーム
福村 拓真 (ふくむら たくま) - EMアプリケーション部 Materialグループ 第2チーム
主事 青山 佳敬 (あおやま よしたか) - EM第1技術開発部 第1グループ
グループ長 元木 創平 (もとき そうへい) - JEOL ASIA PTE. LTD.
シニアプロダクトマネージャー 及川 哲夫 (おいかわ てつお)
研究支援
本研究は、日本学術振興会 (JSPS) 科学研究費補助金基盤研究B「イオン駆動力供給体の電子線とX線による作動機構の解明 (研究代表者:米倉功治) 」、同挑戦的萌芽研究「電子線結晶構造解析によるクーロンポテンシャルの可視化 (研究代表者:米倉功治) 」、科学技術振興機構 (JST) 先端計測分析技術・機器開発プログラム「電子顕微鏡の高精度制御及び生体高分子結晶構造解析ソフトウェアの開発 (研究代表者:米倉功治) 」などの支援を受けて行われました。
1.背景
生活習慣病や花粉症などの治療には、長期保管や経口投与のできる低分子医薬品が使われます。低分子医薬品の安定した薬効を保証するためには、含まれる有効成分の結晶構造を管理することが重要です。特に、低分子有機化合物は同じ化学式であっても、複数の結晶構造(結晶多形)や溶媒和物(結晶擬多形)の構造をとりえます。結晶構造が異なると、それぞれの溶解度や安定度などが異なるため薬効も変化します。
通常、製剤における結晶構造は、粉末X線回折[2]や固体核磁気共鳴 (固体NMR) を用いて決定されます。しかし、製剤には有効成分だけでなく、でんぷんや糖などの賦形剤[7]が含まれているため、そのX線回折パターンやNMRスペクトルは、有効成分と賦形剤からの信号が重なり合った複雑なものとなります。また、もし製剤中に未知の結晶構造が存在していた場合は、その存在を検出することはできません。
たとえば、鎮痛剤として用いられるインドメタシンとカフェインの未知の共結晶が市販の製剤中に観測された例が挙げられます。この共結晶は、インドメタシンとカフェインを粉末状態ですり合わせることで生成されますが、元のそれぞれの結晶とは溶解性が異なるため、薬効が異なることが分かりました。結晶をすり合わせるというプロセスは、製剤の過程でよく用いられるものです。このような理由から、製剤中の有効成分の結晶構造を直接決定する技術が強く求められています。
しかしながら、結晶構造の決定法として広く用いられている単結晶X線回折では、少なくとも10マイクロメートル (μm、1μmは100万分の1メートル) 程度の単結晶が必要であり、製剤に含まれる100ナノメートル (nm、1nmは10億分の1メートル) ~1μm (0.1~1μm) 程度の低分子有機化合物の有効成分の微結晶から結晶構造を直接決定することはできません。また、微結晶粉末試料からの構造解析法として用いられている粉末X線回折は、単一成分からなる粉末試料を要求し、混ざり物である製剤から直接構造を決定することはできません。
一方、電子回折で用いられる電子線と物質の相互作用はX線と比べると1~10万倍程度も強いため、0.1~1μm程度の微結晶からでも十分な回折パターンを得ることができます。そこで、ごく最近になり、電子回折を用いた低分子医薬品の構造解析も報告され、注目を集めています。しかし、電子回折では、炭素、窒素、酸素といった原子番号の近い原子を取り違えることが多く、さらに医薬品中の水素結合を理解するのに重要な水素がはっきりと見えないといった問題があります。
2.研究手法と成果
共同研究グループは、透過型電子顕微鏡[8]を用いた電子回折による全体構造解析と固体NMRによる局所解析とを第一原理量子化学計算により統合させることで、0.1~1μm程度の低分子有機化合物の微結晶から、結晶構造、水素結合構造を正しく解明する手法を開発しました。
この手法ではまず、電子回折により大まかな結晶構造を調べますが、水素が見えないことのほか、炭素・窒素・酸素が区別できないことから、複数の異性体が構造候補として挙がります。そこで、これら異性体の固体NMRスペクトルを、第一原理量子化学計算を用いて計算します。この計算NMRスペクトルと、実測の固体NMRスペクトルを比較することにより、どの異性体が正しい構造かを明瞭に決定できます。
具体例として、構造が既知のアミノ酸L-ヒスチジンの微結晶の場合、電子回折を用いて構造解析を行うと (図1) 、分子構造上、炭素・窒素・酸素原子が全く異なる帰属となっており、また水素原子の数や位置がでたらめになっていることが分かります。また、分子構造の知見に加え、固体NMRの測定結果によって訂正した構造 (図2) であってもなお四つの構造の可能性があります。そこで、計算NMRスペクトルと固体NMRスペクトルを比較することにより、一つの構造に絞り込めます (図3)。
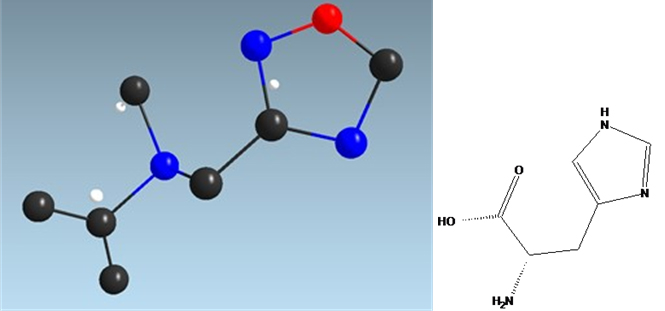
図1 L-ヒスチジンの構造式と電子回折を用いて得られた初期構造
黒が炭素、青が窒素、赤が酸素、白が水素を示す。ヒスチジンの化学式はC6H9N3O2だが、構造式と比較するとそれぞれの原子の帰属が全く異なることが分かる。
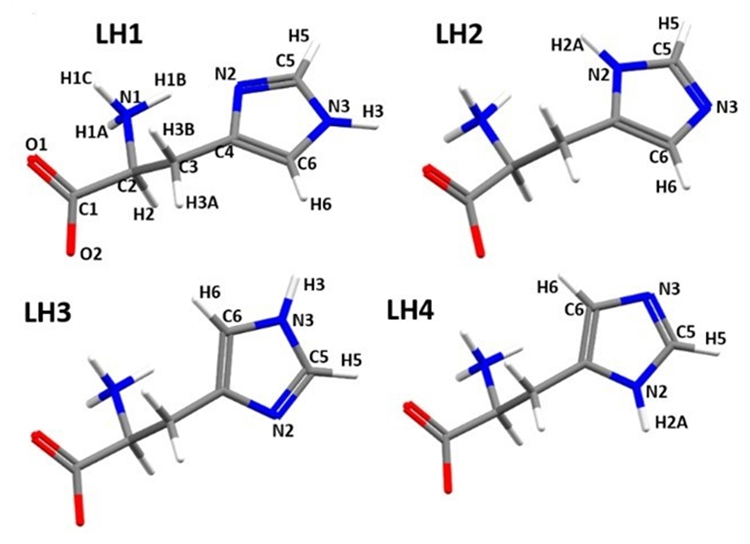
図2 固体NMRの測定結果から絞り込んだ四つの構造
側鎖のイミダゾイル基(5員環の部分)が異なる四つの異性体に絞り込まれた。
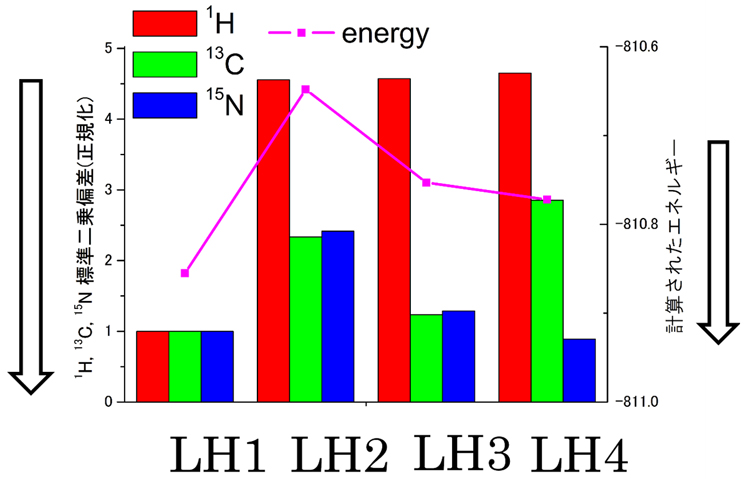
図3 実側と計算NMRスペクトルの比較と計算で得られたエネルギー
棒グラフは、実験で得られた固体NMRスペクトルと量子化学計算で得られたNMRスペクトルの平均二乗偏差を示す(左軸)。平均二乗偏差が小さいほど、二つのスペクトルが近いことを示す。紫の折れ線グラフは、量子化学計算で得られた結晶格子のエネルギーで、エネルギーが小さいほど安定なことを示す(右軸)。最も安定で最も実験NMRスペクトルと一致することから、LH1が正しい構造と決められた。
本手法を用いて、シメチジン結晶形B[6]の構造決定を行いました。具体的には、電子回折により大まかな構造決定を行い、結晶形Bと結晶形Cが混ざり合った試料の中から類似の結晶パラメーターを持つ結晶からの電子回折データを集めることで、結晶形Bの構造を決めることに成功しました。
今回の研究成果により、電子回折による構造の不確かさを固体NMRと第一原理量子化学計算により補い、最終的に一つの構造を導き出しました。また、得られた結晶構造で分子内、分子間で複雑に水素結合している姿が見られ、シメチジン結晶形Bの安定化機構が明らかになりました(図4)。

図4 シメチジン結晶形Bの微結晶の電子顕微鏡像と得られた結晶構造
左は、シメチジン結晶形Bの電子顕微鏡写真。右は、左の赤丸内の、固体NMRおよび電子回折、量子化学計算により得られた結晶構造。青は窒素原子、黄は硫黄原子、灰色が炭素原子、白が水素原子を示している。結晶構造はオレンジ線で示される水素結合により安定化されている。右下は、右上の構造を真横から見たもの。
3.今後の期待
今回の研究成果では、電子回折と固体NMRとを第一原理量子化学計算を通じて有機的に結合することで、ナノサイズの微小な結晶から水素の位置も含めた精密な結晶構造解析が実現しました。本手法の混合物であっても解析ができる特徴を生かし、医薬品への応用が期待できます。低分子医薬品の精密な結晶構造が、錠剤や散剤などの状態で決定できるため、今後、より安定した品質保証に貢献することが考えられます。また、これまで見逃されてきた未知の結晶形の発見も期待できることから、医薬品の改善にもつながります。
このほか、医薬品だけでなく微結晶試料一般への応用が考えられます。例えば、ガス吸着・貯蔵・イオン伝導体などさまざまな構造機能化学材料として有望視され、盛んに研究されている多孔性金属錯体(PCP/MOF)[9]が挙げられます。結晶性が高いPCP/MOCは容易に微結晶試料が得られることから、本手法を適用することで、研究開発が加速すると期待できます。
4.論文情報
<タイトル>
Understanding hydrogen-bonding structures of molecular crystals via electron and NMR nanocrystallography
<著者名>
Candelaria Guzmán-Afonso†, You-lee Hong†, Henri Colaux, Hirofumi Iijima, Akihiro Saitow, Takuma Fukumura, Yoshitaka Aoyama, Souhei Motoki, Tetsuo Oikawa, Toshio Yamazaki, Koji Yonekura, Yusuke Nishiyama
†These authors contributed equally to this work
<雑誌>
Nature Communications
<DOI>
10.1038/s41467-019-11469-2
5.補足説明
[1] 理研-JEOL連携センター
理研と日本電子株式会社 (JEOL) が共同で設立した連携センター。分析・診断機器分野における独自技術の創出を目指し、2014年11月に開設。
参考:2014年10月31日トピックス「「理研CLST-JEOL連携センター」を開設」
http://www.riken.jp/pr/topics/2014/20141031_1/
[2] 単結晶X線回折、粉末X線回折
X線回折とは、X線を結晶に照射させて得られるX線の散乱パターン (X線回折像) から、結晶内の原子の配列の仕方 (結晶構造) や電子の分布の仕方 (電子密度分布) を決定する手法であり、試料に単結晶を用いる場合、単結晶X線回折と呼ばれる。試料に単結晶の集合である粉末を用いる場合、粉末X線回折と呼ばれる。単結晶X線回折は粉末X線回折に比べて、試料準備が困難、測定に時間がかかるなどのデメリットがある反面、回折ピークの重なりが少ない、回折強度が強いなどのメリットがある。
[3] 電子回折
結晶に電子線を照射して、散乱パターンを観測する手法。透過型電子顕微鏡を用いて観測される。X線回折では電子密度分布が得られるのに対して、電子回折では静電ポテンシャルが得られる。X線回折、中性子線回折と並ぶ回折手法の一つ。X線や中性子線と比べると、非常に小さい結晶から回折パターンが得られることが特徴。
[4] 固体核磁気共鳴 (固体NMR) 法
原子核には核スピンがあり、これがゼロではない水素や炭素原子の一部は強い磁場の中に置かれると、複数のエネルギー状態に分かれる。このエネルギー差に相当する電磁波を当てると、共鳴現象が起きて電磁波が吸収される。その振動数は、原子核の種類と磁場の強さで決まるが、原子核の周りの電子の状態に影響されるので、周辺の電子の分布や原子の結合状態を知る手がかりになる。従って、NMRは分子構造の決定手段として、また信号の強度から核スピンの数が分かるため、定量測定の手段としても用いられる。測定対象となる物質を溶媒に溶かす溶液NMR法に対し、固体状態の物質を測定するNMR法を固体NMR法と呼ぶ。固体サンプルのNMR信号は、分解能が非常に低いが、磁場方向に対して試料を54.7°傾けて高速回転させて計測するマジックアングル試料回転 (MAS) 法を用いることにより、分解能・感度ともに向上させることができる。固体サンプルの測定に広く用いられているNMR法。NMRはNuclear Magnetic Resonanceの略。
[5] 第一原理量子化学計算
経験則や実験データに頼ることなく、量子力学理論のみを用いて電子状態を計算する手法。最も安定なエネルギーを与える構造を計算することによって、構造の最適化を行ったり、電子状態からNMRで観測されるパラメーターを計算できる。
[6] シメチジン、シメチジン結晶形B
ヒスタミンH2受容体拮抗薬として有名。胃酸の過剰分泌を抑える。合理的医薬品設計のアプローチを用いて開発された初めての医薬品。A, B, C, Dの4つの異なる結晶形およびM1, M2, M3の水和結晶などさまざまな結晶形を取ることが知られている。医薬品として安定した効能を発揮するためには、結晶形をコントロールすることが非常に重要。C10H16N6Sの化学式で表される。シメチジンを開発したジェームス・ワイト・ブラックは、1988年にノーベル生理学医学賞を受賞。 ただし、シメチジン結晶形Bの構造は長らく未知であった。それは、結晶形Bは針状結晶であるために、単結晶X線回折に必要な大きさの単結晶を作製することが困難だったことに起因。さらに、結晶形Bは結晶形Cとしばしば混ざった状態で結晶化されることから、粉末X線回折による解析も困難であった。
[7] 賦形剤
医薬品を錠剤・散剤などの剤形において、希釈や成型のため、また取り扱いを便利にするために加えられる無害の添加物。でんぷんや糖などが広く用いられている。
[8] 透過型電子顕微鏡
通常の光学顕微鏡では可視光を試料に当てて観察するのに対し、透過型電子顕微鏡では試料に電子線を当て、透過してきた電子線の強弱から試料の形態を観察する。電子線の波長は可視光よりもはるかに短いため、理論上0.1nm程度の分解能が得られ、生体分子やその複合体の構造解析に用いられる。ただし、電子と物質の相互作用が強いことがあだとなって、厚みのある試料を観察できない。
[9] 多孔性金属錯体 (PCP/MOF)
リンカと呼ばれる多座配位子と金属イオンが配位結合することにより構成される配位高分子。多くは多孔性を示し、ガス吸着、ガス分離、導電性など有用な物性を持つ。
PCP /MOF はPorous Coordination Polymer/Metal-Organic Frameworkの略。
