クライオ電子顕微鏡法の技術開発と生命科学への貢献
日本電子news Vol.50 No.1
難波 啓一、 加藤 貴之
大阪大学 大学院 生命機能研究科
生体分子の立体構造情報は、生命科学のみならず医療創薬にとっても基盤的な情報であり、ここ数年は従来のX線結晶解析法やNMR法に加えてクライオ電子顕微鏡法が注目を浴びている。電子線照射によって容易に損傷を受ける生体分子の像は、どのようにしたら高分解能で記録でき、その画像解析により原子レベルの立体構造解析ができるのか。クライオ電子顕微鏡法における我々独自の技術開発の歴史と現状、そして今後一層の技術開発による将来への期待と展望を紹介する。
はじめに
2017年のノーベル化学賞は、クライオ電子顕微鏡による生体分子の立体構造解析法のパイオニアである、ジャック・デュボシェ(Jacques Dubochet、スイス・ローザンヌ大学)、ヨッキム・フランク(Joachim Frank、米国コロンビア大学)、リチャード・ヘンダーソン(Richard Henderson、英国MRC分子生物学研究所)の3氏に贈られた。生体分子の立体構造情報は、生命科学のみならず医療創薬にとっても重要な基盤情報で、ここ数年は従来のX線結晶解析法やNMR 法に加えてクライオ電子顕微鏡法が目覚ましい進歩を遂げ、構造解析手法の基盤技術の一つとしてその立場を確立した。ごくわずかな水溶液試料で原子レベルの分解能を達成できる構造解析手法として注目を浴び、この技術の創始者としての貢献を認められての受賞である。ここでは、我々が独自に進めてきたクライオ電子顕微鏡法における工夫とそれによる技術の進歩、そして今後一層の技術開発による将来のポテンシャルについてご紹介したい。
クライオ電子顕微鏡による生体分子の立体構造解析法
バクテリアや酵母などの単細胞微生物から動物植物などの多細胞生物、そして高次脳機能を持つヒトにいたるまで、多様な生物の生命活動を支える様々な仕組みは見事なほどに共通している。そういった機能はすべて、タンパク質や核酸などを構成する数千個から数万個の原子の立体配置によって決まる分子構造を基盤としているからである。しかもその立体構造は柔らかくてダイナミックで、熱ゆらぎをも積極的に活用できる動的な構造で機能するよう設計されている。生命科学の大きな課題の一つは、こういった機能を発現するメカニズムの解明であり、そのために数十万から数百万種類におよぶ様々な生体分子の立体構造を解明することが必要である。
クライオ電子顕微鏡法、特に単粒子像解析法の特徴は、X線結晶構造解析に必須な試料の結晶化が必要なく、NMR法の応用を制限する試料の分子量上限がないことである。ただ、生体分子ではその立体構造を保持する原子間結合の大半が水素結合やイオン結合のような非共有結合であるため、金属や半導体などの試料に比べて電子線照射損傷がひどい。できる限り損傷を抑えて高分解能の分子像を高画質で記録するためには、生体分子の水溶液を薄膜として急速凍結することで非晶質の氷薄膜に包埋し、液体ヘリウムや液体窒素で冷却した試料ステージ上で低温に保持したまま電子線を照射し、電子顕微鏡像を記録することが要求される。実はそれでも原子レベルの損傷を与えず照射できる電子線量は20 ~ 30 e-/Å2以下に制限されるため、電顕像は物理学的統計ノイズやランダウノイズ(個々の入射電子検出信号レベルの大きな分布によるノイズ)によりきわめて画質の悪いものとなる。しかも、個々の分子像は様々な向きで氷薄膜に包埋された分子の投影像であるため、立体像を再構成するには様々な方向で投影された像をできるだけむら無く数多く集めることも必要となる。すなわち、できる限り多くの分子像を効率よく収集し、投影方向毎に分類した分子像の向きと位置を揃えて平均像を得ることで、ノイズレベルを減少させ信号レベルを劇的に向上させることが必須となる。その上で各平均像の投影方向の相対関係を決め逆投影することで、初めて高分解能の立体像を再構成することが可能となる(Fig. 1)。そのために必要なのは、できるだけ高画質の電顕像を効率的に収集できるクライオ電子顕微鏡と画像検出器、そして高精度で高速な画像解析プログラムと高速計算機である。そういった課題の解決を目指して我々が独自に進めてきた装置開発の歴史と成果を以下にご紹介する。
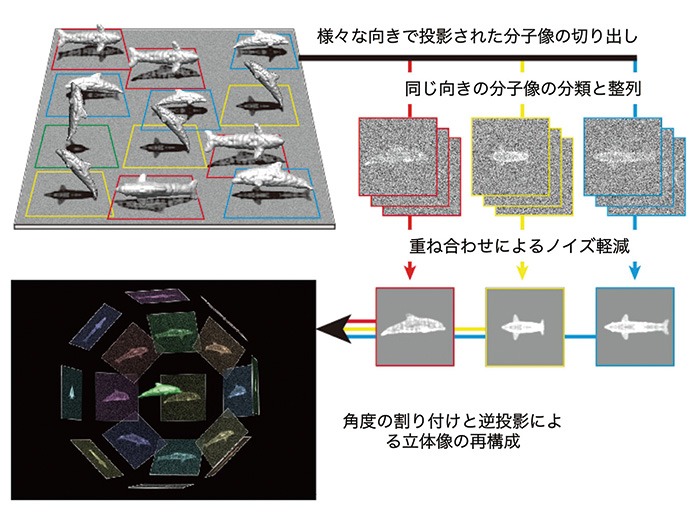
Fig. 1 単粒子像解析法の模式的説明図
様々な向きで氷包埋された生体分子をイルカに模して、その投影像であるノイズレベルの高い電顕像から二次元クラス平均像を経て立体像を再構成するプロセスを模式的に表示。
クライオ電子顕微鏡と画像検出器そして画像データ収集法と解析法の進化
電界放出型電子銃
日本国内におけるこの分野のパイオニアは藤吉好則博士(名古屋大学客員教授)である。1980年代に世界で初めて液体ヘリウム冷却の安定な試料ステージを日本電子と共同開発し、電子線照射損傷を極限まで抑えて高画質電顕像の記録を可能にした[1]。私自身は1990年頃から藤吉博士と共同研究を始めてクライオ電顕法の教えを請い、それまでX線繊維回折法とX線結晶構造解析法に頼っていた細菌べん毛繊維の構造解析にクライオ電顕法を採り入れた。1994年には松下電器産業(株)が京阪奈学研都市に設立した基盤技術研究所内に国際研究所という組織を一緒に立ち上げ、上記の液体ヘリウム冷却の試料ステージを持つクライオ電子顕微鏡にショットキータイプの電界放出型電子銃(Thermal FEG)を導入した。それがJEM-3000SFF(日本電子製)である(第3世代: G3)[1]。藤吉グループは膜タンパク質の二次元結晶構造を対象に、我々はべん毛繊維のような超分子複合体を対象として高分解能の立体構造解析を目指した(Fig. 2)。画像検出器として銀塩フィルムしか使えなかったため高画質画像データ収集の効率は悪く、数年におよぶ長期間のデータ収集と画像解析が必要であったが、それでも数多くの顕著な成果が得られ、2000年代半ばまでには原子レベルの分解能で膜タンパク質二次元結晶や超分子の立体構造解析が可能になった[2-5]。べん毛繊維では僅か4万個余りのフラジェリン分子の電顕像から4 Åに近い分解能を達成し、そのポリペプチド主鎖の折りたたみとアミノ酸側鎖が解像できるようになった(Fig. 3)[6]。

Fig. 2 難波グループにおけるクライオ電子顕微鏡開発の経緯
赤字は新規に導入あるいは開発した新しい要素技術。
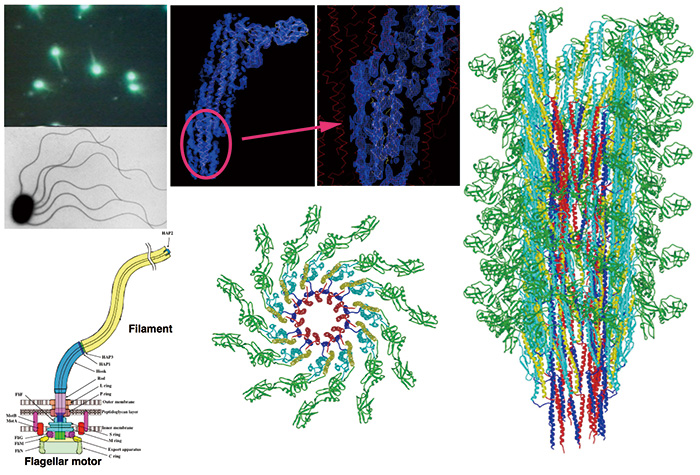
Fig. 3 細菌の遊泳運動を駆動するべん毛繊維のクライオ電子顕微鏡による分子構造
JEM-3000SFFと銀塩フィルムで撮影した電顕像のらせん対称性を活用した構造解析。電子顕微鏡像の解析からタンパク質分子のアミノ酸の主鎖側鎖が初めて解像され、構成タンパク質フラジェリンの巨大な複合体としてのべん毛繊維全体の原子モデルが構築された[6]。
CCDカメラとΩ型エネルギー分光器
阪大学大学院生命機能研究科が2002年に発足し、吹田キャンパスに2004年に完成したナノバイオロジー棟に我々の研究室が移転した際、文科省の補正予算により、液体ヘリウム冷却クライオ電子顕微鏡に新たな要素技術を導入した電子顕微鏡システムがJEM-3200FSCである(Fig. 2)。藤吉博士が理研播磨研究所に導入した第4世代(G4)[1]の改良版である。新たな要素技術の一つは鏡体内に設置されたΩ型エネルギー分光装置の改良型第2世代で、氷薄膜での非弾性散乱によりエネルギーが僅かに低下し干渉性を失った電子線は高分解能の電顕像には寄与せず高い背景ノイズとなるが、エネルギー分光装置は非弾性散乱電子の大半を除去して背景ノイズを大幅に低減し、画像のS/Nを2倍程度に向上できることを明らかにした[7]。そしてもう一つは画素数4K×4KのCCDカメラ(TVIPS F415MP)である。グラスファイバーの束の上に塗布した薄いシンチレーター層で電子線を光に変換し、それをCCDで検出して画像とするため、シンチレ ーター層における電子線の散乱で画像がぼけてしまい、解像度自体はフィルムに劣っていたが、撮影直後に卓上ディプレーに画像を表示でき、そのフーリエ変換像も即座に確認できるため、電顕像の画質と分解能を短時間で確認評価でき、高画質電顕像の効率的な収集に大きく貢献した[7]。さらに、液体ヘリウムタンクから試料ポッドへの液体ヘリウムの供給を止めることにより、試料温度を4Kという極低温から50K程度まで上昇させたことで、高画質像データの収集効率が劇的に向上した。極低温では電子線照射損傷は最小限に抑えられるが、試料の電気伝導度が極めて悪いため、もともと電気伝導度の低い氷薄膜の電子線照射によるチャージアップにより、撮影した電顕像の大半で分子像が一方向にブレたように記録され、そのため画像解析に使える高画質電顕像の歩留まりは数%以下であった。試料温度を50K程度に上昇させることでこの問題が解決し、撮影したほぼすべての電顕像が解析に使えるようになった[7]。
この技術的進歩により、それまでは年単位の期間を要したデータ収集と画像解析を1 ~ 2週間程度にまで短縮できるようになり、細菌べん毛フックや筋肉のアクチン繊維、細菌の細胞分裂時にプラスミドを分配するParM繊維、病原性細菌が宿主細胞への感染時に使う3型分泌装置のニードル繊維、そして筋肉のミオシン頭部が強結合したアクチン繊維などの立体構造が5 ~ 7 Å分解能で次々と解析できるようになった[7-12]。タバコモザイクウイルスのコートタンパク質が形成するスタックディスクでは3.8 Å分解能の構造が得られた(藤井、未発表)。
サイドエントリー型ヘリウム冷却ステージ
藤吉博士が日本電子と1980年代に共同開発したクライオ電子顕微鏡の液体ヘリウム冷却試料ステージは、トップエントリー型できわめて安定な試料ステージであったが、傾斜機構がないため電子線トモグラフィーはできず、二次元結晶の傾斜像の撮影にも特殊な工夫が必要であった。そこで藤吉博士は2003年に、傾斜機構を備えたトップエントリー型ヘリウム冷却試料ステージの開発予算を科学技術振興調整費に申請し、私も分担者としてこのプロジェクトに加わった。この傾斜機構付トップエントリー型液体ヘリウム冷却のクライオ電子顕微鏡(第6世代:G6)が京都大学と大阪大学に納入されたのは2006年である(Fig. 2)[1]。我々はこの顕微鏡で、電子線クライオトモグラフィー法による細部内生体超分子の構造観察法の開発と確立を目指した。研究対象とする回転モーターの細菌べん毛基部体は、通常は界面活性剤で細胞膜を溶解して単離精製し、急速凍結により氷薄膜に包埋してクライオ電顕像を撮影し、単粒子像解析法により立体構造を解析するが、基部体に弱く結合している膜タンパク質の固定子やべん毛タンパク質輸送装置は単離精製の際に解離してしまうため機能状態の構造を観察できない。そこで、この新しい傾斜機構付クライオ電子顕微鏡による電子線クライオトモグラフィー法により、菌体そのものを急速凍結して氷包埋し、細胞膜を貫通したままのべん毛基部体の構造の詳細な観察を試みた。ただ残念ながら、サルモネラ菌の菌体は直径が1 μmあり、60度傾斜像の撮影では電子線が透過する試料厚が2 μmにもなるため、加速電圧300 kVの電子線では高分解能の傾斜像の撮影は困難で、膜貫通基部体の詳細な構造解析は数年後のミニセル試料の導入によってようやく可能になった[13]。
我々は単粒子像解析法のためのクライオ電顕像データの収集効率を一層向上させるため、2011年にこのクライオ電子顕微鏡の試料ステージを、コンピューター制御が容易で自動撮影を可能にするポテンシャルを持った、日本電子独自のサイドエントリー型に変更した(第6世代改造型: G6N)(Fig. 2)。そしてこの試料ステージの導入は、我々の期待を超える分解能の向上と使い勝手の良さをもたらした。クライオ電子顕微鏡の撮像分解能の確認で必須なのは、氷包埋した生体分子像の撮影時に低分解能の像コントラストを増強するため大きなデフォーカスをかけるのと同様に、アモルファス金属薄膜等のテスト試料を1 μm程度の大きなデフォーカス条件で撮影し、そのフーリエ像に見えるThonリング(Fig. 4参照)がどの分解能まで伸びているか確認することである。設置完了日に行った撮像分解能の確認テストで、Pt/Ir薄膜試料の像を1 μmデフォーカスで撮影した電顕像のフーリエ像には、Thonリングが2.0 Å分解能を超える領域まで伸びていることが確認できたのである。このようなデフォーカス条件でThonリングが高分解能まで伸びるためには、電子線を試料に対して平行照射することが必要であるが、この試料ステージに組み込まれた対物レンズのポールピースは、ユーザーが意識せずとも平行照射条件が実現されるような電子光学系になっていたからである。
だが一方で別の問題があった。この試料ステージは液体ヘリウム冷却ではあるが、トップエントリー型とは冷却方式が異なるため試料温度が10 ~ 15Kと少し高めで、しかも第4世代のように試料ポッドへの液体ヘリウム供給を止めて試料温度を50K程度まで上昇させることができなかったことである。しかも、ちょうどそのころ世界的にヘリウムの供給が制限されて価格も高騰していた。我々のクライオ電顕施設は建築時に大阪大学吹田キャンパスの低温センターにヘリウム回収パイプを繋いであり、ヘリウムの回収と液化により低価格でのヘリウム供給体制が整ってはいたものの、ヘリウム回収ラインが空気の混入しやすい構造であったため低温センターにたびたびご迷惑をかけていた。そこで、2012年頃に液体ヘリウムの使用を止めることにした。鏡体内の液体窒素タンクと液体ヘリウムタンクの両方に液体窒素を充填して試料を冷却したところ、試料ステージ温度を液体窒素温度である77Kに7 ~ 8時間は安定に保持したまま電顕像を撮影することが可能になった。そして、TVIPSのCCDカメラの駆動ソフトシステムを活用して、ほぼ自動に近い撮影による効率的な画像データ収集が可能になった。
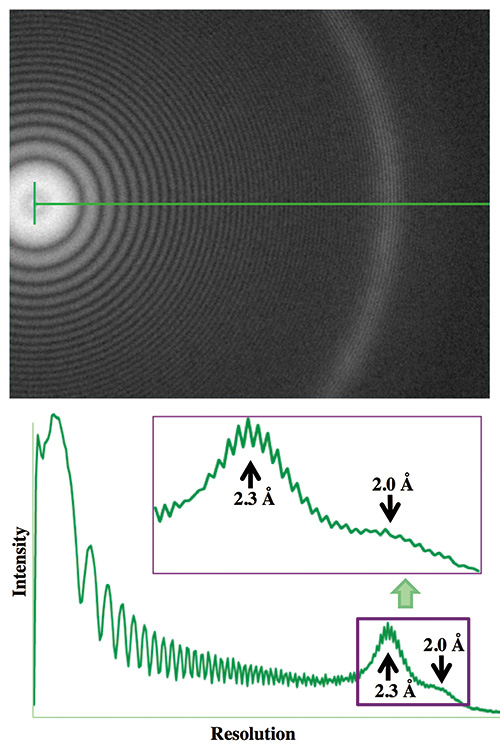
Fig. 4 CRYO ARM™で撮影したPt/Ir薄膜像のフーリエ像のThonリングとプロファイル
Pt/Ir薄膜試料をCRYO ARM™により1 μmデフォーカスで撮影した像のフーリエ像にはThonリングが1.8 Å分解能まで伸びている。
電子線直接検知型CMOSカメラ
そしていよいよ、2013年の電子線直接検知型CMOSカメラの登場である。カリフォルニア大学サンフランシスコ校のDavid Agardはその数年前から、カリフォルニア大学バークレイ校のグループが開発していたX線画像検出器のCMOS素子を電子顕微鏡用に転用すべく、 Gatan社と共同で素子の開発を進めていた。Gatan社はこのCMOS素子を用いた電子顕微鏡画像検出器システム(Gatan K2 Summit)を2013年に完成させ販売を開始した。300 kVで加速された電子線を直接受けてもダメージを受けず、素子の層が薄いために電子線の散乱による像ボケも最小限で、画素数4K×4Kで1600万画素の画像を毎秒400フレームで撮影できるのが大きな特徴である。もともと電子線照射損傷を抑えるために20 ~ 30 e-/Å2程度の低電子線量で撮影するクライオ電顕像では、撮影時間を数秒から10秒程度に延ばせばフレーム毎に素子に入射する電子線は数えられる程になり、フレーム毎に単電子検出が可能になる。CCDカメラのようなエネルギー蓄積型の画像検出素子では入射電子ごとに蓄積されるエネルギーが大きく変化するため、それがランダウノイズと言われる大きなノイズ源となり、画素毎に入射する電子数が少ないため無視できない統計ノイズとともに、低電子線量で撮影するクライオ電顕像の大きなノイズの原因であるが、単電子検出によりこのランダウノイズを消滅させることが可能になった。
カリフォルニア大学サンフランシスコ校のYifan ChengはこのCMOSカメラシステムの性能を最大限に活用し、熱や辛みを感知する膜タンパク質受容体イオンチャネルのTRPV1の立体構造を解析し、2013年の暮れに2報の論文をNature に発表した[14, 15]。長らく結晶化に苦労した精製膜タンパク質試料の僅かな水溶液でクライオ試料グリッドを作成し、撮影した約1000枚のクライオ電顕像から拾い出した約10万個の単粒子像を解析することにより3.4 Å分解能の立体像を得て、分子モデルの構築に成功した。この画像解析で高分解能達成に威力を発揮したのは、単電子検出した高速フレームを数十枚ずつ積算することで毎秒5フレーム程の動画像として電顕像を記録し、試料グリッドの機械的ドリフトや電子線照射で引き起こされる氷薄膜の歪みによって起こる像ぶれを補正して画像をシャープにする方法である[16]。
我々も2015年にこのCMOSカメラGatan K2 Summitを導入できたので、上記のサイドエントリー型クライオ電子顕微鏡(第6世代改造型:G6N)に装着し、画像検出器としてのその高い性能の活用を試みた。上記の動画モード撮影により膜タンパク質を含む様々な生体超分子で原子レベルの分解能が得られるようになり、これまでの最高到達分解能は赤痢菌の3型病原因子分泌ニードルのチューブ構造で得られた2.7 Å(藤井、山田、未発表)である。しかし、分解能は試料分子の構造安定性とクライオ試料グリッド上の氷薄膜の厚さに大きく依存するため、良い試料であれば2.0 Åを超える分解能を達成することは可能なはずである。
CRYO ARM™の開発
米国電子顕微鏡メーカーのFEI社(現Thermo Fisher Scientific)は、1990年代末ごろから生命科学分野の研究者にとって使い勝手のよい高性能クライオ電子顕微鏡の開発に取組み、2004年にPolaraを、2008年にはTitan Kriosを開発し発売した。特にTitan Kriosは、12個のクライオ試料グリッドをマガジンに挿入して試料グリッド自動交換装置(オートローダー )に装填し、遠隔操作で個々のグリッドを鏡体内の試料ステ ージに挿入してその良否を確認した上で撮影領域を指定すれば、自動撮影が可能なシステムとなっている。トモグラフィーによる細胞内分子構造の立体観察にも単粒子像解析による分子構造解析にも、ともに数多くの電顕像データの収集が必要なクライオ電子顕微鏡法にとっては、きわめてユーザーフレンドリーなシステムとして高い評価を得た。
日本電子は2009年に材料研究用の高分解能電子顕微鏡として JEM-ARM200F(通称ARM: Atomic Resolution Microscope)を開発し、世界で高い評価を得ていた。そこで我々はこのARMをベースとして、その高分解能電子光学系の性能を最大限に活かせる安定で自動制御可能なクライオ試料ステージ、Titan Kriosより一層利便性の高いクライオ試料グリッドのオートローダー、そして液体窒素自動充填システムを新規開発し、Ω型エネルギー分光器とともにARM に組み込むことにより、Titan Kriosを超える最先端クライオ電子顕微鏡を実現したいと考えた。ちょうどよいタイミングで、理研生命システム研究センター長の柳田敏雄博士(大阪大学特任教授、名誉教授、脳情報通信融合研究センター長)がセンター発足準備のために 2010年に申請した最先端研究基盤整備事業予算が採択され、理研と阪大の連携拠点形成予算として配分されたので、我々はこの予算の一部を活用し、ARMベースの高度に自動化された高分解能クライオ電子顕微鏡の開発を日本電子に依頼した。我々の構想と要求性能を日本電子の技術陣に詳細に伝え、その後も何度も議論を重ねて装置開発が進められた。その愛称がCRYO ARM™である(Fig. 2)。到達分解能として2.0 Å超えを目標とした。
諸事情により装置開発は予定より遅れたが、プロトタイプ機となる CRYO ARM™は2016年5月に生命機能研究科ナノバイオロジー棟クライオ電顕施設に搬入設置された。初期構想時には、ベースとなるARMが加速電圧200 kVのThermal FEGのみであったため、このプロトタイプ機も同じ仕様である。テスト試料のPt/Ir薄膜の像を1 μmデフォーカスで撮影した電顕像のフーリエ像には、Thonリングが1.8 Å分解能を超える領域まで伸びていることが確認できた(Fig. 4)。我々の重要な役割はここからで、様々な生体分子のクライオ試料グリッドを作成してCRYO ARM™で撮影し、単粒子像解析法で立体像を再構成してその分解能で装置性能を評価するとともに、クライオ電子顕微鏡としての装置や制御ソフトの使い勝手、自動撮影によるデータ収集の効率化、完全自動撮影に向けた自動撮影ソフトの改善など、様々な面で詳細な評価を行い、日本電子の技術陣にフィードバックしてシステム改良のための情報をできるだけ多く提供するよう努めた。予想したことではあったが、設置から約半年間は主にオートローダーや試料グリッドの挿入準備に使うクライオワークステーションの動作に機械的トラブルが頻発した。そのトラブルを解決するため日本電子の技術者がほぼ毎週のように昭島から来訪し、部品の素材や設計を変更し、あるいはセンサーやアクチュエーターの配置を調整するなど、様々な工夫に尽力した。試料ステージの設計も大幅に変更し、平行照射条件やコマフリ ー撮影条件をボタン一つで実現できる電子光学系制御ソフトの導入や、機械系の制御ソフトの改善を含め、顕微鏡システムとしての制御ソフトの改善も実施した。クライオ電子顕微鏡法はこれまでに蓄積された様々なノウハウによって成り立っている。それらをすべて完璧に実現できて初めてクライオ電子顕微鏡システムとして完成したことになる。このプロトタイプ機が安定に稼働するようになったのは2017年2月であったが、それ以降は機械的なトラブルは全く起きていない。
我々は生体分子のテスト試料としてβガラクトシダーゼを用い、高分解能の立体像再構成を試みた。CRYO ARM™のハード・ソフトの改修と並行して、日本電子が提供する自動撮影ソフトJADASの使い勝手や動作安定性についても評価と改善を繰り返しつつ、βガラクトシダーゼの単粒子像データ収集と解析も繰り返し、2017年夏には約3日間の自動データ収集で約2500枚の電顕像を撮影し、拾い出した約35万の単粒子像から8万8千の高画質像を選び出し、再構成した立体像の分解能は2.6 Åであった(Fig. 5)(加藤、EMDB登録 ID:6840)。
日本電子は2017年6月にCRYO ARM™の製品版を発表し、加速電圧によってCRYO ARM™ 200およびCRYO ARM™ 300と名付けた。両者ともに冷陰極電界放出型電子銃(Cold FEG)とホールフリー位相版が標準装備されている。ホールフリー位相版は分子重量150 kDa以下の比較的小さな生体分子の構造解析に威力を発揮する。そして、 Cold FEGはショットキータイプに比べてエネルギー分散が半減し、電子線の干渉性がきわめて高いことにより高分解能の画像信号が大幅に増強される。実際にPt/Ir薄膜のデフォーカス像で比較するとその違いは明らかで、200 kVのThermal FEGでは1.8 Å程度に留まったThonリングが300 kVのCold FEGでは1.1 Å前後まで伸びている。すなわち、この高分解能を活かせる超安定なクライオ試料ステージを開発して組込むことができれば、生体分子の水溶液試料の構造解析で1 Å分解能という夢が実現する可能性がある(Fig. 6)。画像データ収集と解析を並行して進めるパイプラインソフトや、その過程で解析結果の良し悪しを判断するAIソフトを進歩させれば、構造解析のスループットを大幅に向上させることも可能である。こういった技術課題の達成を目指して、日本電子との共同技術開発は現在も進行中である。
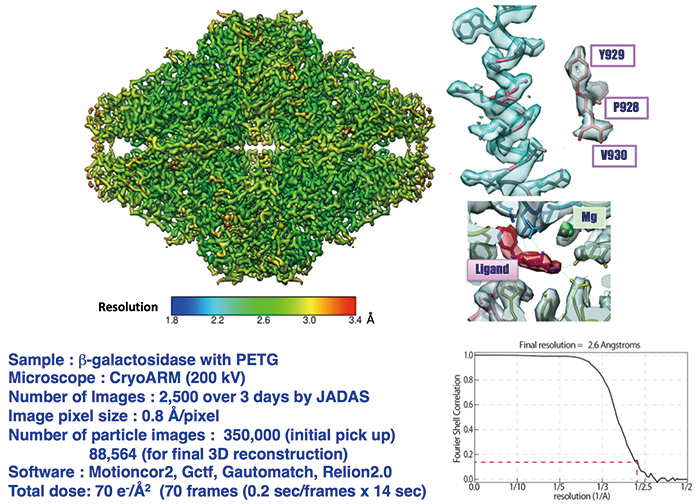
Fig. 5 CRYO ARM™によるβガラクトシダーゼの2.6 Å分解能の構造
分子構造全体の平均分解能は2.6 Åであるが局所分解能は均一でなく、レインボーカラーで表示すると、2 Åに近い分解能を示す場所もあり、Tyr929では六員環の密度に孔が見える。
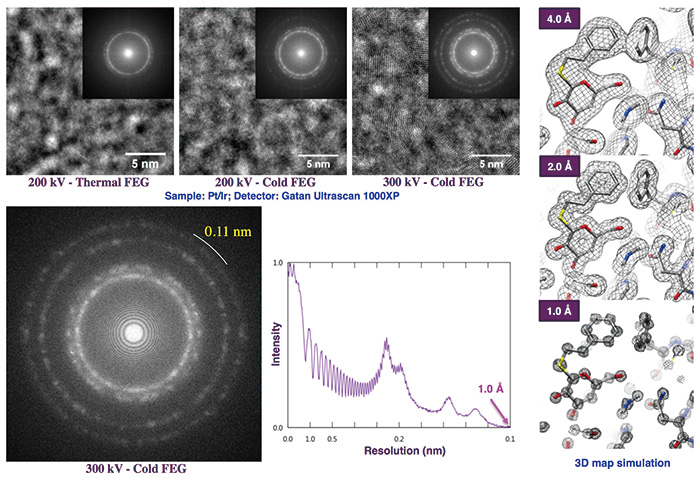
Fig. 6 Cold FEGによる高分解能画像信号の増強効果と各分解能の3Dマップ
電顕像試料はPt/Ir 薄膜を約1 µmデフォーカスで撮影した。右側のマップのシミュレーションでは、クライオ電子顕微鏡像解析の現在の平均的な分解能4 Åでアミノ酸側鎖の形が、 1 Å分解能では個々の原子が解像できることが示されている。データは日本電子の飯島寛文氏、金子武司氏、元木創平氏、石川勇氏、大藏善博氏によるもの。
結論(まとめ、おわりに)
生命の様々な機能や仕組みはすべて生体分子のダイナミックな相互作用ネットワークで決められているため、解離会合を繰り返す生体分子複合体の構造を原子レベルで詳細に解明することが生命機能の解明には必須である。これまでは結晶化の必要性や分子量の上限に制限されて見ることのかなわなかった無数の分子構造や分子間相互作用が、クライオ電子顕微鏡法によりどんどん見えるようになってきた。クライオ電子顕微鏡が今後の生命科学、医学、医療創薬分野の発展に果たす役割は計り知れない程大きい。クライオ電子顕微鏡法に関わる技術開発をさらに一層推進してこの重要な役割を最大限に果たす技術とすることは、人類社会の最重要課題の一つである言っても過言ではない。
謝辞
1990年代初めにクライオ電子顕微鏡法の技術開発と応用を開始して以来永らくお世話になっている藤吉好則博士と、日本電子の技術陣、経営陣、本社、大阪支店の方々に深く感謝したい。
参考文献
- 藤吉好則: 日本電子ニュース 41, 13-21 (2009).
- Kimura Y, Vassylyev DG, Miyazawa A, Kidera A, Matsushima M, Mitsuoka K, Murata K, Hirai T, Fujiyoshi Y: Nature 389, 206-211 (1997).
- Murata K, Mitsuoka K, Hirai T, Walz T, Agre P, Heymann JB, Engel A, Fujiyoshi Y: Nature 407, 599-605 (2000).
- Miyazawa A, Fujiyoshi Y, Unwin N: Nature 423, 949-955 (2003).
- Gonen T, Cheng Y, Sliz P, Hiroaki Y, Fujiyoshi Y, Harrison SC, Walz T: Nature 438, 633-638 (2005).
- Yonekura K, Maki-Yonekura S, Namba K: Nature 424, 643-650 (2003).
- Fujii T, Kato T, Namba K: Structure 17, 1485-1493 (2009).
- Fujii T, Iwane AH, Yanagida T, Namba K: Nature 46, 724-8 (2010).
- Gayathri P, Fujii T, Møller-Jensen J, van den Ent F, Namba K, Löwe J: Science 338, 1334-1337 (2012).
- Fujii T, Cheung M, Blanco A, Kato T, Blocker AJ, Namba K: Proc. Natl. Acad. Sci. USA 109, 4461-4466 (2012).
- Fujii T, Namba K: Nature Commun. 8, 13969 (2017).
- Fujii T, Kato T, Hiraoka KD, Miyata T, Minamino T, Chevance FF, Hughes KT, Namba K: Nature Commun. 8, 14276 (2017).
- Kawamoto A, Morimoto YV, Miyata T, Minamino T, Hughes KT, Kato T, Namba K: Sci. Rep. 3, 3369 (2013).
- Liao M, Cao E, Julius D, Cheng Y: Nature 504, 107-112 (2013).
- Cao E, Liao M, Cheng Y, Julius D: Nature 504, 113-118 (2013).
- Li X, Mooney P, Zheng S, Booth CR, Braunfeld MB, Gubbens S, Agard DA, Cheng Y: Nature Methods 10, 584-590 (2013).
