汎用TEMを用いたクライオ電子顕微鏡観察 −氷包埋試料作製からクライオ観察まで−
EM2022-04
はじめに
透過電子顕微鏡 (TEM) は、薄膜試料を透過した電子を電子レンズによって拡大し透過像を取得する装置である。生物試料をTEMで観察するときは以下の注意が必要である。一つ目は真空中に試料をおく必要があるため生きた状態での観察はできないこと、二つ目は電子線照射により試料の構造が変化してしまうことがあることである。
クライオTEM法は、試料を凍結し、凍結状態を保ってTEM観察する手法である。特に水などの液体中に分散した粒子状試料では、試料を溶液ごと凍結した氷包埋試料を観察するため、①液中の試料構造を観察でき、生きた状態に近い構造を捉えることが可能となる、②試料はとり囲む氷によって冷却されるので電子線照射で発生する熱によって試料が壊れるのを低減することが可能となる。汎用TEMを使用したクライオ観察は、クライオトランスファーホルダーを使用することで行えるが、ホルダーの取り扱いやTEMの操作時に留意点がいくつかある。本稿では、試料作製から像観察までの一連の流れを紹介する。
クライオ観察時に用意する物

1. 親水化処理装置
グリッドの親水化処理を行う。

2. 自動浸漬凍結装置
氷包埋試料を作製する。
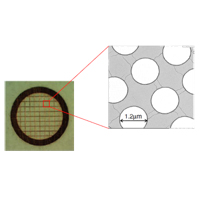
3. グリッド
孔開きカーボン膜が張られた
グリッドを使用する。

4. 液体窒素
試料やツールを冷却、及び
エタンガス液化に使用する。

5. エタンガス
試料の凍結時に冷媒として使用する。

6. グリッドボックス
液体窒素中でグリッドを保存する。

7. クライオトランスファーホルダー
氷包埋試料をTEMに搬送し観察する。

8. ポンピングステーション
ホルダーを真空引きする。
氷包埋試料作製
ウイルスや生体タンパク質などの粒子状の試料の氷包埋試料 (Fig. 1) は、①厚さが電子線を透過できる程度 (数十~数百 nm)、②氷は非晶質にする必要がある。この二点を実現するために、自動浸漬凍結装置 (Leica社製EMGP) (Fig. 2) を使用し氷包埋試料を作製したのでその一連の手順を示す。
〜手順〜
- 親水化処理装置を使用しグリッドの親水化処理を行う。
- 自動浸漬凍結装置 (EMGP) の準備を行う。
➀本体電源をいれ、チャンバー内が設定した温度・湿度になるまで待つ。
②液体窒素タンクに液体窒素を注ぎ、エタンコンテナが-180°C以下に冷却されるまで待つ。
③エタンガスをエタンコンテナに入れ液化する。
④親水化処理をした孔開き支持膜付きグリッドをピンセットで掴む。
⑤グリッドを掴んだピンセットをチャンバー内にセットする。 - マイクロピペットで試料が分散した溶液を数μl量り取り、グリッドに滴下する (Fig. 2(a))。
- 余分な試料液をろ紙で吸う (Fig. 2(b))。
*凍結後の試料の厚みを調整するために行う。 - ピンセットをチャンバーからエタンコンテナ中の液体エタンに落とし、試料の急速凍結を行う (Fig. 2(c))。
*急速凍結することで、非晶質の氷で試料を包埋する。 - 凍結したグリッドを液体窒素雰囲気下でエタンコンテナから液体窒素中のグリッドボックスに移し、保存する。
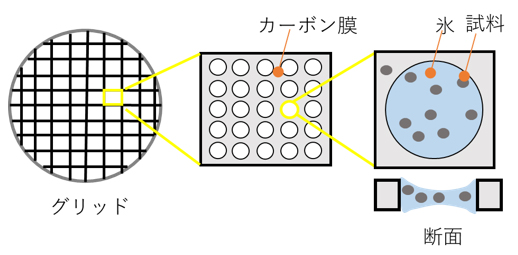
Fig. 1 氷包埋試料
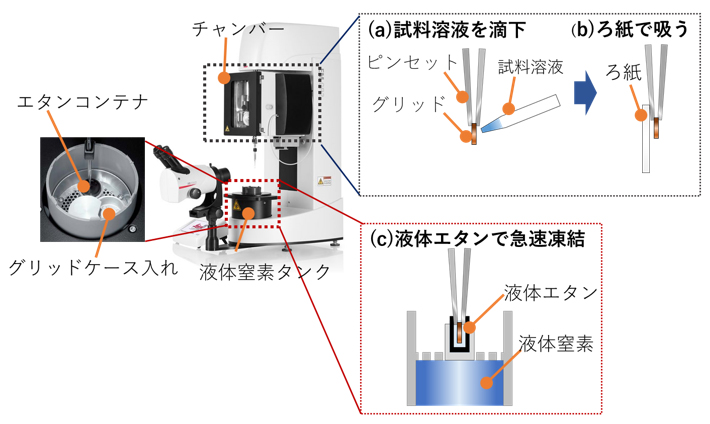
Fig. 2 EMGPの構造と氷包埋試料作製方法
〜氷包埋試料作製のポイント〜
各条件 (試料濃度・親水化処理条件・試料滴下量・ろ紙で吸う時間など) を最適化することで、試料が分散し、かつ氷が薄い試料をつくることができる。
試料搬送
氷包埋試料は、凍結状態を保ったままでホルダーにセットし、TEMに搬送する必要がある。
クライオトランスファーホルダーはGatan社製のモデル698 (Fig. 3) を使用した。試料搬送・TEM観察を行う一連の流れを示す。
〜手順〜
- クライオトランスファーホルダーの準備を行う。
➀ポンピングステーションで数時間真空引きする。
*デュワーを真空引きすることで、冷却状態を約8時間維持できる。
②ホルダーをワークステーションと温度コントローラーにセットする。
③デュワーとワークステーションに液体窒素を注ぎ、ホルダー先端部を-180°C以下に冷却する。
*温度コントローラーでホルダー先端部の温度を確認できる。 - EMGPのエタンコンテナからワークステーションにグリッドボックスを移す。
- グリッドボックスからグリッドを取り出し窒素雰囲気下でグリッド装填部にセットする。
- グリッド装填部をシャッターで覆ってから、TEMにホルダーを挿入する。
*シャッターをすることで、グリッドへの霜の付着を軽減する。
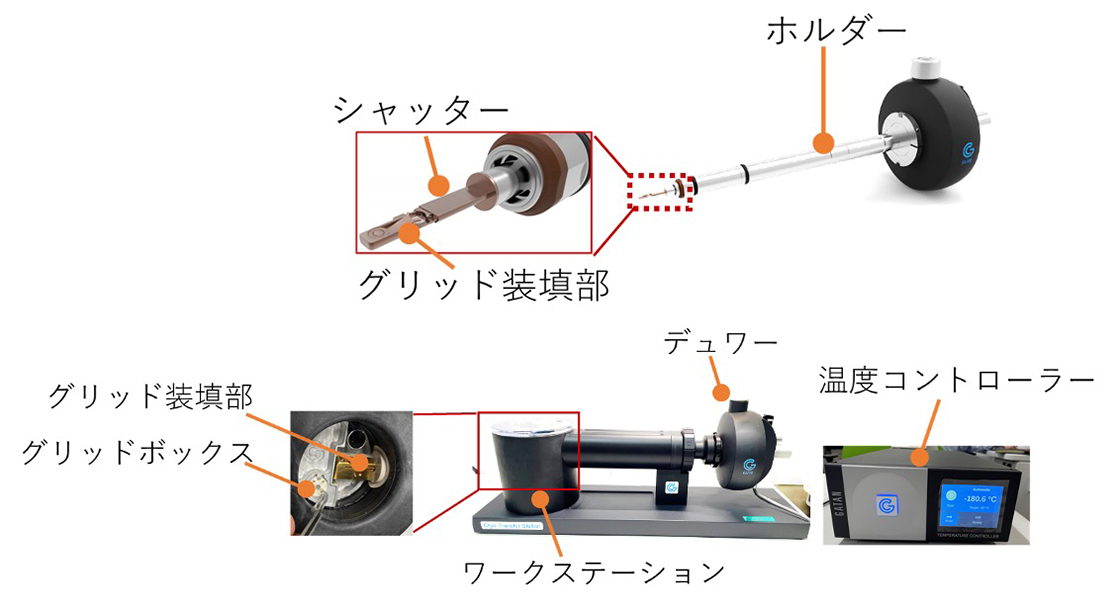
Fig. 3 クライオトランスファーホルダーの構造
クライオ観察
氷包埋試料を観察するには、氷が溶けないように試料への電子線ダメージを低減する必要がある。
MDS (Minimum Dose System) は、視野探し、フォーカス合わせ、撮影までの一連の流れを低電子線量で行うシステムである。
以下にクライオトランスファーホルダーをTEMに挿入後、MDSを使用しクライオ観察を行う流れを示す。
〜手順〜
- 極低倍率で試料の状態を確認する。
*氷が厚すぎて試料を確認できない場合や、ろ紙で液を吸いすぎて凍結された試料が支持膜の穴に存在しない場合は、試料作製の条件を検討しもう一度やり直す。 - 撮影倍率 (通常 :x10k〜x100k程度) と、試料に当てる電子線照射量 (通常 : 20-40 e-/Å2程度) を決め、それに応じたMDSの各モードの倍率、また各モードで使用する視野を設定する (Fig. 4)。
➀Searchモード… 視野探しを行うモード。
低倍率を用いるため試料ダメージはほとんどない。②Focusモード… フォーカスを合わせるモード。
撮影箇所近くの支持膜上でフォーカスを合わせる。③Photoモード… 撮影を行うモード。
撮影時の倍率、電子線照射量を設定する。 - 設定したMDSのSearch、Focus、Photoの三つのモードを使い分けて観察・撮影を行う。
*ここで注意するのは正焦点ではほとんどコントラストがつかないので、Photoモードでは数百 nm〜数 μmのデフォーカスをかける。
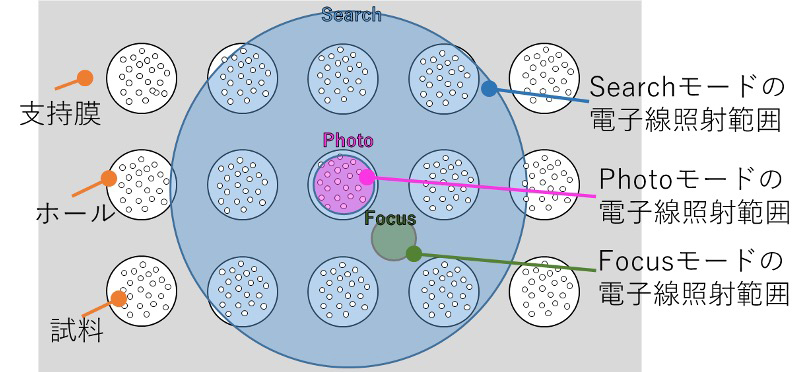
Fig. 4 MDSの各モードにおける電子線照射範囲
~クライオ観察のポイント~
倍率、電子線照射量、デフォーカス量を適当に変化させていくつか像を撮影し、より良い画像を取得する条件を得ることができる。
クライオ観察データ
上記の流れで氷包埋試料作製、試料搬送、クライオ観察を行い取得したTEM像をFig. 5 (a)、Fig. 5 (b)に示す。
Fig. 5 (a) では、加速電圧120 kVの透過電子顕微鏡JEM-1400Flashを用いて取得したリポソームのクライオ像である。ネガティブ染色では捉えることが難しい多層構造を捉えることができた。
Fig. 5 (b) では、加速電圧200 kVの透過電子顕微鏡JEM-F200を用いて取得したタンパク質 (アポフェリチン) のクライオ像である。分散したアポフェリチン粒子の画像を取得することができた。
Fig. 5 (c) は、自動撮影ソフトJADASで取得した2,800枚のTEM像から175,499粒子を拾い、単粒子解析により求めたアポフェリチンの三次元構造である。このように、自動撮影ソフトを使用することで、単粒子解析などによって三次元構造を取得することもできる。


Fig. 5 汎用TEMを用いて取得したクライオ観察データ
- このページの印刷用PDFはこちら。
クリックすると別ウィンドウが開きます。 
PDF 1.1 MB
