アレイトモグラフィー法による生物試料の三次元観察
SM067
はじめに
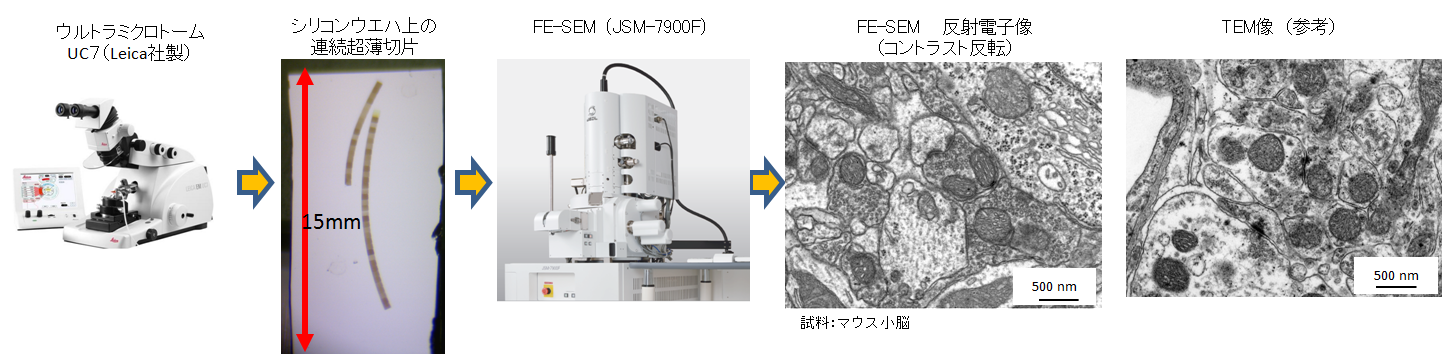
アレイトモグラフィー法とは、固定し樹脂包埋した生物試料などから連続超薄切片を作製後、各切片の同一場所を透過電子顕微鏡(TEM)または走査電子顕微鏡(SEM)で観察し、その連続断層画像を積み重ねることにより、三次元観察を行う手法である。ここでは、SEMを用いた手法とデータを紹介する。
SEMによるアレイトモグラフィー法の特徴
- SEMと反射電子検出器の性能向上により、TEM像に迫る画質が得られる。
- ソフトウェアにより、自動観察が可能。
- 大きな試料を装填・観察できる。
- SEM用の連続切片は、シリコンウエハーやスライドガラスのような固い基板に載せることができるので、TEM用の連続切片作製に比べ比較的簡単。
- 切片の大きさや枚数に制限がないので、XYZ方向に広範囲で三次元観察ができる。
- 必要な装置は、ウルトラミクロトームとSEMのみで、特別の装置を必要としない。
- 連続切片は、酢酸ウラニルやクエン酸鉛で後染色を施すことによりコントラストを上げることができるのでNCMIR法のような特別な試料固定法は必要なく、通常の二重固定したエポキシブロックを試料に用いることができる。
- 観察後に試料がそのまま残るので、再観察等ができる。
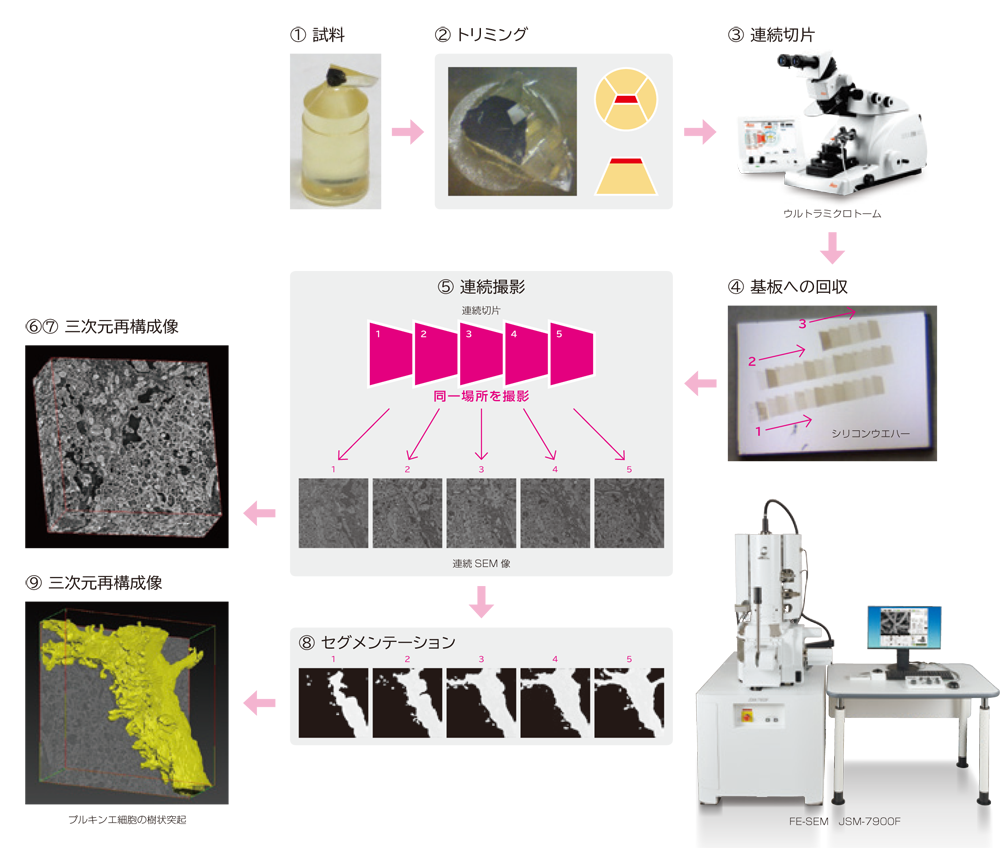
アレイトモグラフィー法による三次元再構成の流れ
通常のTEM観察用に固定したエポキシ包埋試料から、連続切片を観察、位置合わせし積み重ねることにより、組織や細胞の三次元再構成を行うことができる。
大略の手順を図示した。
手順
- ① 試料(エポキシブロック)
- ② トリミング
- ③ 連続超薄切片の作製(ウルトラミクロトーム)
- ④ 基板への回収
- ⑤ SEMによる連続観察撮影
- ⑥ 撮影データの位置合わせ
- ⑦ 積み重ねによる三次元再構成
- ⑧ セグメンテーション
- ⑨ 三次元再構成像の表示、解析
小脳分子層の三次元再構成
| 試料 | マウスの小脳 |
| 固定法 | グルタルアルデヒドと四酸化オスミウムによる二重固定 |
| 後染色 | 酢酸ウラニル、クエン酸鉛による二重染色 |
| 撮影画像サイズ | 5,120 × 3,840 pixels |
| Pixel Size | 6 nm |
| 切片の厚さ | 45 nm |
| 撮影枚数 | 97枚 |
| 三次元再構成範囲 | 12.3 x 12.3 x 4.5 μm (2k x 2k x 97 pixels) |
| 位置合わせソフト | Fiji(フリーソフト https://fiji.sc ) |
| 三次元再構成ソフト | Stacker(SIF社製) |
| セグメンテーションソフト | Colorist(SIF社製) |

三次元再構成範囲から、樹状突起2本、軸索6本、シナプス、グリア細胞1個を選択し、セグメンテーションを行った。
軸索と樹状突起とグリア
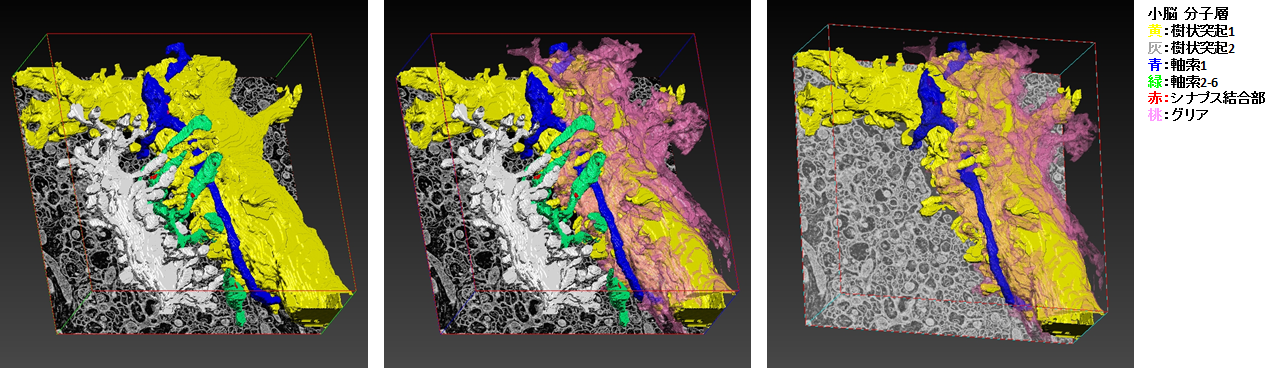
アレイトモグラフィー法による生物試料の三次元再構成① ~マウス小脳 分子層の神経組織~
FE-SEM(JSM-7900F 、JEOL製)の反射電子像(BEI)を用い、小脳の神経組織の一部を、アレイトモグラフィー法により三次元再構成しました。
小脳組織の連続切片を積み重ねることにより三次元再構成し、注目する細胞・構造をセグメンテーションしています。
◆再生ボタンをクリックするとムービーが始まります (約2分) ◆
樹状突起と軸索のシナプス

アレイトモグラフィーー法による生物試料の三次元再構成② ~マウス小脳 分子層のシナプス周辺~
FE-SEM(JSM-7900F、JEOL製)の反射電子像(BEI)を用い、小脳の分子層のプルキンエ細胞の樹状突起と軸索間のシナプス周辺を、アレイトモグラフィー法により三次元再構成しました。
連続切片を積み重ねることにより三次元再構成し、注目する細胞・構造をセグメンテーションしています。
◆再生ボタンをクリックするとムービーが始まります (約10秒) ◆
- このページの印刷用PDFはこちら。
クリックすると別ウィンドウが開きます。 
PDF 1.66MB
