タンパク質の3D構造を超高速で解析
―クライオEM向け試料作りを10分で―

INTERVIEW 15
大阪大学大学院薬学研究科
生体構造機能分析分野
井上 豪 教授
生命化学や創薬の研究ではタンパク質など生体分子の三次元構造が欠かせない情報になってきた。クライオ電子顕微鏡を用いた解析手法が普及するなか、その作業スピードを劇的に速めるツール「EG-grid™」を開発した井上教授にその特徴を聞いた。
クライオEMの急速な普及
タンパク質の三次元構造解析の手法としてクライオ電子顕微鏡 (以下、クライオEM) が急速に普及してきている。国際的な公共データベースのPDB (Protein Data Bank) には日々新たに解明された生体高分子 (タンパク質、核酸など) の三次元構造データが登録されていて、論文が発表されるとデータが公開される運びとなるのだが、公開された構造データのうち電子顕微鏡によって解明された件数が、2024年は年間5,791件に上った。これは、同年の全公開数の37%に達している。
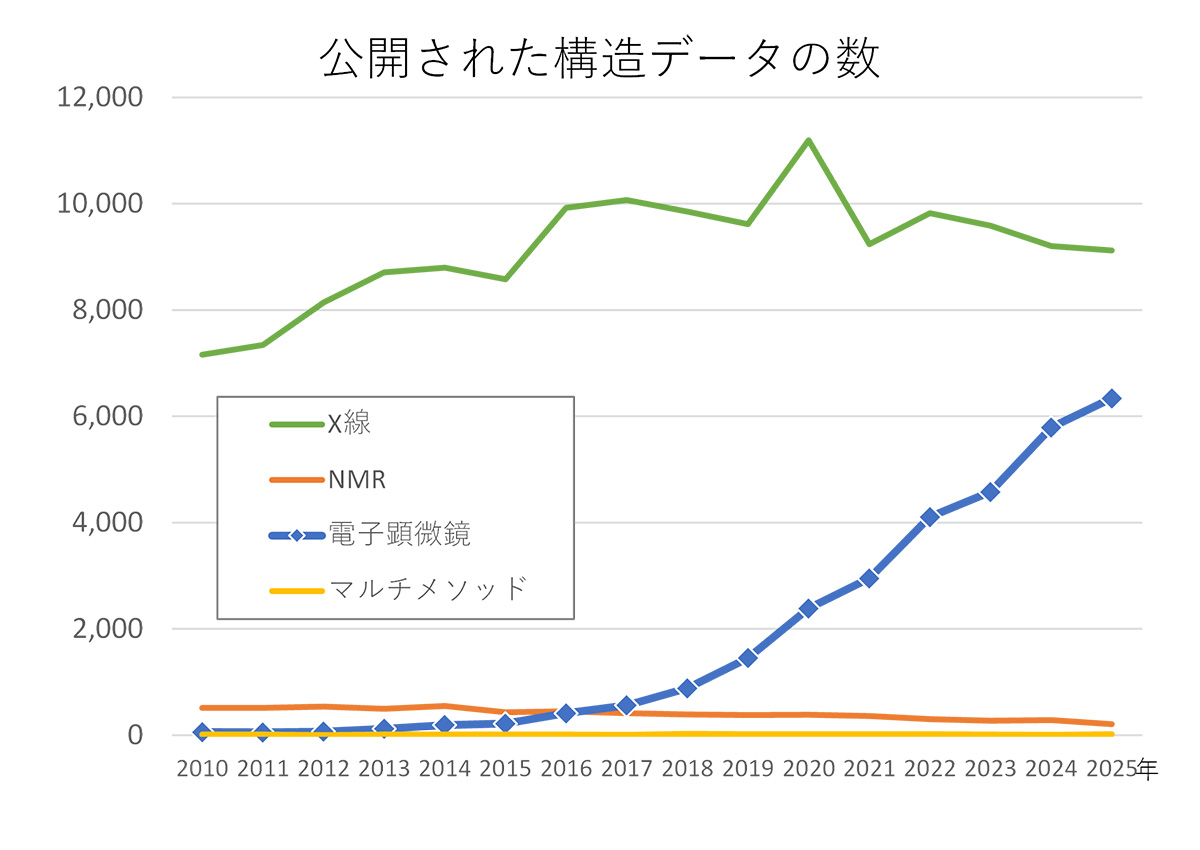
解析手法別に見た年間PDB公開数の推移。PDBで公表している統計データを元に作成。2025年の数字は12月3日までのもの
グラフを見ると、電子顕微鏡によるデータが増え始めたのは2017年あたりからと見える。実はこの年は、クライオ電子顕微鏡の基礎技術を生み出した欧米の3人の研究者に、ノーベル化学賞が授与された年。「ノーベル賞をきっかけにクライオEMとその手法の認知度が上がり、利用が加速した」と井上 豪 教授 (大阪大学大学院薬学研究科) は言う。
クライオEMが人気である理由は、これまでX線結晶構造解析で必須だったタンパク質の結晶化が不要になることだ。X線結晶構造解析は三次元構造を知る中心的な手法であるが、この手法ではタンパク質を100
μm程度の大きな結晶にする必要がある。試料作りに数カ月以上かかる場合もある上、そもそも結晶化が難しいタンパク質や複合体も存在する。
クライオEMは、そうした結晶になりにくいタンパク質でも解析できる点が強みになっている。
また、少ないサンプル量で解析できることも大きなメリットだ。精製が難しいタンパク質や、不安定ですぐに凝集してしまう複合体でも構造解析に挑戦しやすくなった。
クライオEMでも試料準備に1カ月
ではクライオEMだと手間がかからないかというとそうでもない。当初は試料作製や撮影に時間がかかっていた。
三次元構造の解析には単粒子解析法を用いるが、この手法では一つひとつ分かれている単粒子の画像を、クライオEMで多数撮影していく。精度を高めるためには様々な角度から撮影した多くの画像を用意して、これらを基にコンピュータで立体構造を再構成する。そのため効率よく撮影できる適切な試料作りが研究のスピードアップに欠かせない。
試料を作るとき、これまでは氷包埋法 (こおりほうまいほう) が用いられていた。溶液を急速凍結させタンパク質を非晶質な氷で包み込む方法だ。しかし、この方法は濃度調整が難しいという課題があった。濃度が高すぎると粒子が重なってしまい有効な画像が得られず、逆に低いと粒子が少なく撮影効率が悪くなる。また、氷に厚みがあり、厚み方向にタンパク質粒子が分散しているとピントの合う粒子が限られてしまい、やはり撮影効率が落ちてしまう。
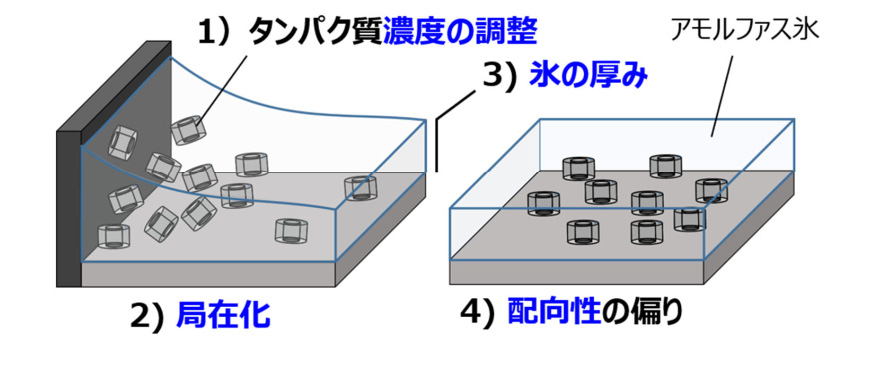
氷包埋法による試料作製の問題点
「濃度調整もたいへんですが、氷包埋法で一番問題なのは優先配向といってタンパク質が同じ方向を向いてしまうことなのです」(井上教授)。
優先配向は凍結過程で発生する。また凍結前から同じ方向を向く場合もある。疎水性の高いタンパク質が気液界面に吸着され同一方向を向いてしまうケースだ。従来の試料作りではこうした条件の検討に1カ月近くかかる場合もあるという。
井上教授らはこうした問題をみごとに解決する試料作製ツール「EG-grid™ (Epoxidized Graphene Grid)」を開発した。EG-grid™はグラフェンを支持ベースとしてこれにエポキシ基を付加したもの。エポキシ基にはタンパク質粒子の表面に存在するリジン残基を捉える性質があるので、タンパク質粒子をさまざまな角度で吸着することができる。エポキシ基の密度はあらかじめ適切に設定されているので溶液の濃度調整に悩むことはなくなり、また厚み方向への分散もなく、撮影のピント面もほぼ揃うのだ。
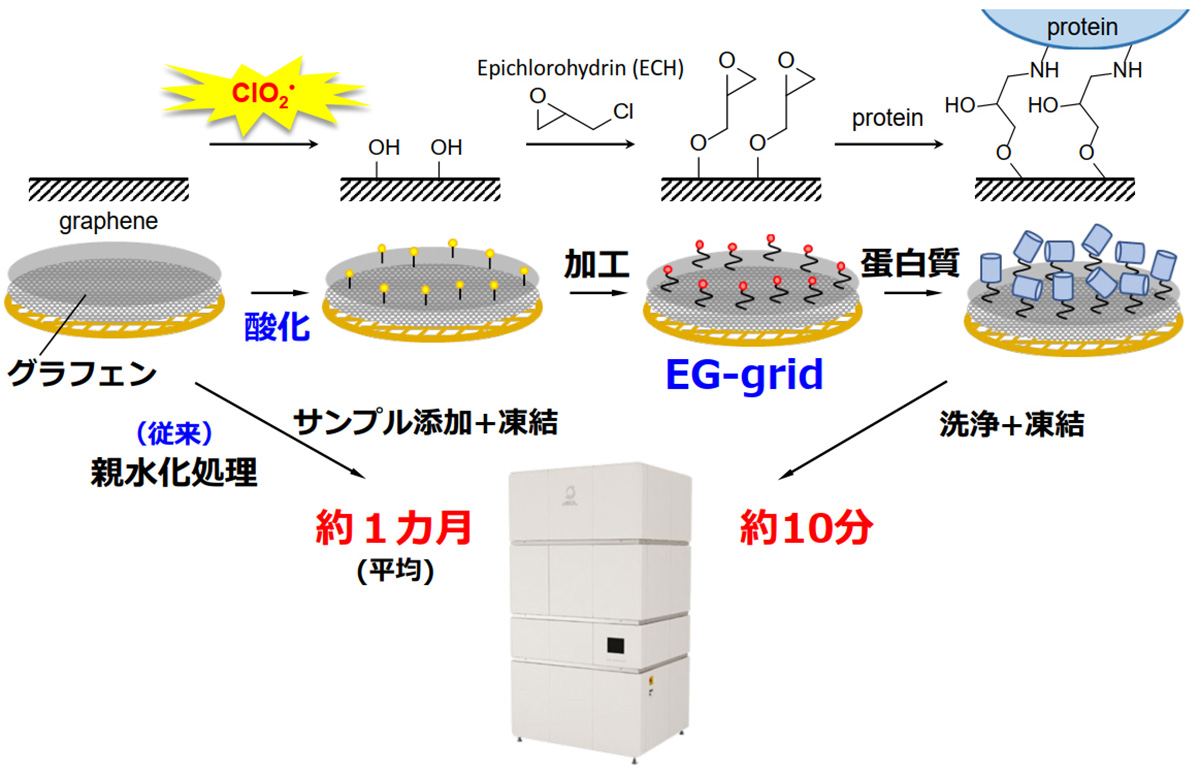
このEG-grid™を利用することで、これまで1カ月近くかかっていた作製時間が10分、あるいは10数分に縮まった。凍結処理を含めても20分程度でクライオ電子顕微鏡にセットできるようになった。
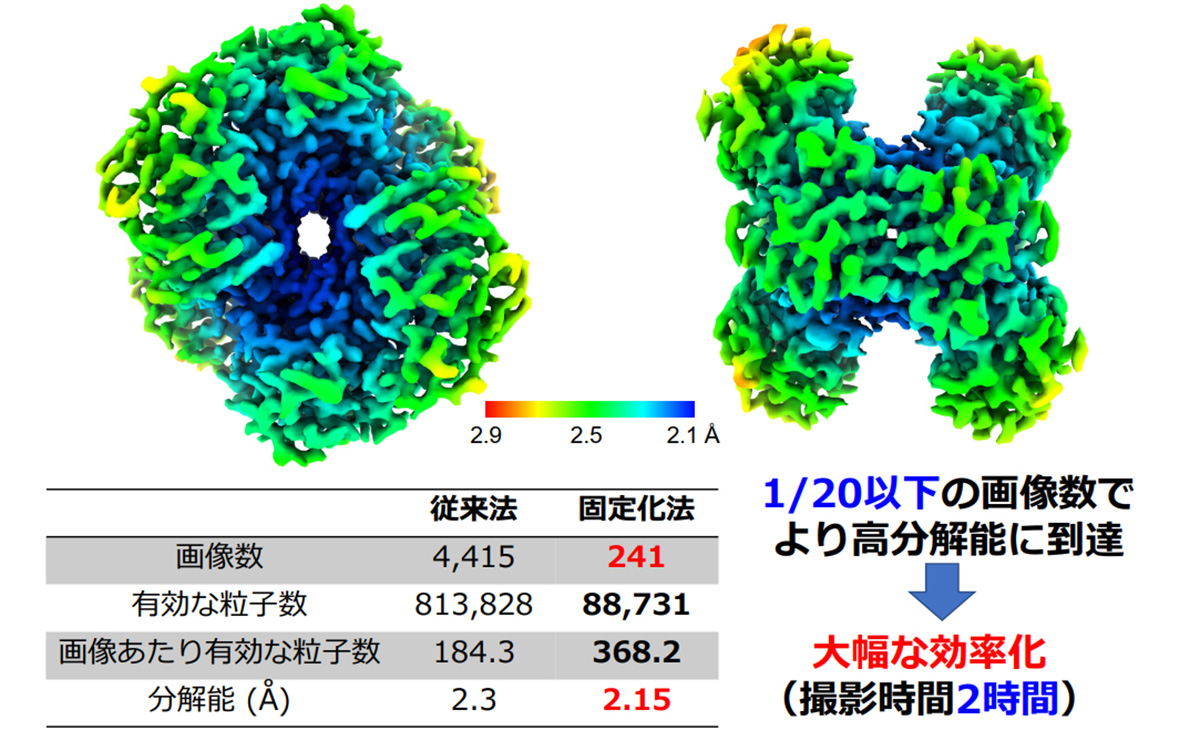
撮影効率も上がった。氷包埋法の試料に比べて1回の撮影で得られる有効な粒子数が増えたため、より少ない撮影枚数で済むようになった。タンパク質によっては従来の1/10、あるいは1/20以下の画像枚数で解析ができるという。
Protein-Bの構造解析例
従来法(氷包埋法)と固定化法(EG-grid使用)の撮影効率を比較した
開発のきっかけは"謎の除菌消臭剤"
EG-grid™の開発は、ある"謎の除菌消臭剤"との出会いから始まった。
2015年、大阪大学に1件の相談が寄せられた。「末期の口腔がんの方にこの除菌消臭剤を、におい消しとして使ってもらっていたら、がんが退縮したという。どんなメカニズムなのか解明してもらえないか。効果が本物なら抗がん剤にしたい」。そういった主旨の相談が持ち込まれ、一緒に"謎の水"が渡された。「成分は何か」と問うても「それは言えない」という。
なんとも怪しい話だが、ラジカルの専門家である工学研究科の福住俊一教授 (当時) に解析を依頼すると、すぐに主成分とメカニズムを突き止めた。主成分は亜塩素酸イオン (ClO2-)。反応すべき菌やウイルスが存在する時にのみ、このClO2-が、水の中で、必要な量だけ反応性の高い二酸化塩素 (ClO2) を生成するメカニズムであることが分かった。
後に大阪大学ではこの安全性の高い"水"を「要時生成型亜塩素酸イオン水溶液」(MA-T:Matching Transformation System) と呼ぶことにした。塩素系ガスを生成する他の物質との混同を避けるためである。
福住教授と同じ研究グループで解析を担当した大久保特任教授 (当時) は光化学の専門家で、「これに光を当てたらどうなるだろう」と興味がわいてきた。酸性条件下で二酸化塩素をガスとして放出させ、これに光を当ててみたところ活性酸素と塩素ラジカルに分かれることに気付いた。そしてこの活性酸素と塩素ラジカルを使うと、いろいろな物質を酸化させられることも分かってきた。

大阪大学先導的学際研究機構
創薬サイエンス部門
大久保敬 教授
例えばメタンを酸化させ、メタノールとギ酸を生成させることができた。二酸化炭素の排出はない。常温・常圧の環境下でのメタノール合成は世界初のことだった。メタンは牛の糞尿、あるいは石油・天然ガスの採掘現場で得られるが運搬しにくいことが問題だったが、液体のメタノールやギ酸にすることで輸送しやすくなり、また活用の幅も広がる。
この酸化反応をクライオEMに活用したのがEG-grid™である。グラフェンの表面を酸化してヒドロキシ基 (-OH) が付けば、そこにタンパク質を固定化する官能基が付けられるのではないか―。そのような発想が、EG-grid™の開発へとつながっていった。
このように新たに見つけた酸化反応や安全性の高いMA-Tを、広い用途に展開できると考えた井上教授は、科学技術振興機構 (JST) の産学共創プラットフォーム共同研究推進プログラム (OPERA) に応募した。実用化研究を進めるためである。ところが採択されるためにはかなりの額の共同研究費を集める必要があるという。期限は3カ月もない。そのときの奔走に応えた企業の一つが日本電子だった。
同社は2018年に「大阪大学-日本電子YOKOGUSHI協働研究所」を設置していたので、ここから研究費を出すことにした。井上教授の提案は無事、OPERAに採択された (実施期間2019年10月~2024年3月)。EG-grid™の開発も進められることになったのだが、YOKOGUSHI協働研究所に導入されていた日本電子のCRYO ARM™ 200がそれを支えることにもなった。
このOPERAは多くの成果を生みだし高く評価された。2024年2月には第6回 日本オープンイノベーション大賞の内閣総理大臣賞を受賞した。メタン酸化の研究は同年4月に科学技術分野の文部科学大臣表彰を受け、またその取り組みが日本学術会議の提言書「気候危機に対処するための産官学民の総力の結集」(2025年10月公開) で取り上げられている。
特許も数多く創出された。その特許を利用したいとの声が複数の企業から寄せられたことをきっかけに一般社団法人 日本MA-T工業会が設立された (2020年11月)。会員企業は91社、賛助会員は22社/団体に上る (2025年1月時点)。2025年の大阪・関西万博では「大阪ヘルスケアパビリオン」に日本MA-T工業会がブースを設け、人やペットの口腔ケア製品、空間散布・噴霧タイプの環境ケア製品を展示した。いずれも安全性の高いMA-Tのポテンシャルを示す展示となった。
クライオEMの守備範囲はさらに広がる
話をEG-grid™に戻そう。EG-grid™により試料作製が1カ月から10数分に縮まったこと、および撮影時間が2時間ほどに短縮されたことは既に述べた。最後はコンピュータによる解析だが、これが2~3日ほどかかる。もはやコンピュータ処理がネックとなっている状況なのだ。
現在、EG-grid™の姉妹品、つまりエポキシ基に代わって別の官能基を付ける製品も検討している。酸クロライド (塩素化合物) を付けるとエポキシ基よりも速くタンパク質 (のアミノ基やチオール基) と結合する。ただ、取り扱いが難しいため世界には売れない。「Hisタグ付きのタンパク質を固定化できないか」との声に応え、既にいくつか試作品は出来ている。ただ、どれもタンパク質が同じ方向を向いてしまうのが難点。「それでも優先配向とは異なる方向から撮影できるので、ピンチヒッター的な使い方はできる」(井上教授) という。
クライオEMと単粒子解析法の組み合わせの弱点を敢えて探すと、小さなタンパク質が苦手という点だろうか。以前は10万Da (※) 以上でないとだめと言われていた。だが今は5万~6万Daのタンパク質まで解析できるようになった。クライオEMによる三次元構造解析の守備範囲はますます広がっている。
※ Da (ダルトン):12C原子の質量の1/12を1とする質量の単位
「X線結晶構造解析しかなかったころは、このタンパク質は結晶になるのだろうか、なるとしてもいつ出来るのだろうか」(井上教授) という状況に悩むことが多々あったが、今ではある程度の質量のタンパク質であればすぐに分析に着手できるクライオEMが第一選択になっているという。
EG-grid™のニーズが、いままさに高まっている状況なのだ。


井上 豪 (いのうえ つよし)
大阪大学大学院薬学研究科 生体構造機能分析分野
2018年11月より大阪大学大学院薬学研究科に所属。それ以前は工学研究科でX線結晶構造解析を専門として研究を進めてきた。MA-Tとの出会いを契機にクライオ電子顕微鏡の基盤技術開発にも携わり、現在は構造生物学的手法を駆使した新規モダリティーの開発をテーマに創薬研究に従事。
