化学シフト
化学シフト
chemical shift
[目次:分光分析(EELS/EDS/電子構造)]
EELSの内殻電子励起スペクトルにおいて、そのスペクトルの立ち上がりエネルギー (閾エネルギー) が励起原子の結合状態や価数 (化学的環境) の違いにより変わることを化学シフトという。
閾エネルギーは、励起の始状態である内殻準位と終状態の非占有バンドの最低エネルギー準位の差により決まる。化学的環境の違いにより始状態と終状態のエネルギーは変化する。例として、金属とその酸化物における金属原子の内殻電子励起スペクトルの場合を考える (図1)。金属の場合は、スペクトルの閾エネルギーは励起される内殻準位からフェルミ準位直上の準位までのエネルギー差となる。その金属との酸化物の場合は、酸素との結合により金属原子から酸素へ電子が移動するため、金属イオン上の価電子密度は減少する。その結果、内殻電子が受ける原子核の静電ポテンシャルエネルギーが増加する (価電子による核ポテンシャルの遮蔽が減少する) ため、始状態である内殻準位は低エネルギー側にシフトする。そのため、エネルギー差は大きくなり、閾エネルギーは高エネルギー側にシフトする。同じ金属の酸化物でも金属イオンの価数が高いほど内殻準位の低エネルギー側へのシフトは大きくなる傾向がある。加えて、絶縁性の酸化物ではフェルミ準位近傍にエネルギーギャップが生じ、終状態である非占有バンドの底のエネルギーは高エネルギー側にシフトする。したがって、酸化物の閾エネルギーは金属に比べて大きくなり、正 (高エネルギー側) の化学シフトを与えることになる。図2にいくつかのマンガン酸化物について、マンガンのEELSスペクトルの化学シフトの例を示す。マンガンの価数が大きくなるにつれてスペクトルのピークがエネルギーの高い方に数eVシフトしているのが分かる。
上記の説明は、基底状態 (内殻電子が励起されていない状態) に基づいた電子遷移で考えた場合だが、実際には内殻電子が励起されることにより生じる内殻空孔の影響が無視できない。内殻空孔は引力型のクーロンポテンシャルを生じ、近傍の電子が引き寄せられてそれを遮蔽する。これにより内殻準位は高エネルギー側にシフトするが、その影響は小さいと考えられている。
また、絶縁物では、内殻空孔と励起電子が結合した状態(内殻励起子)を形成する場合がある。この場合、バンドギャップ内に励起子準位が形成され、それがEELSの終状態になる場合もある。この場合は、閾エネルギーは励起子の結合エネルギー分だけ減少する。内殻励起子の結合エネルギーは物質に依存し、100 meV程度から1 eV以上になる物質もある。結合エネルギーが大きな内殻励起子は吸収端直前のピークとして観察される。このように、EELSによって測定される化学シフトには終状態の変化も寄与するため解釈が難しいが、標準物質から測定されたスペクトルと比較することで、化学シフトは価数の決定に利用できる。
なお、内殻電子のイオン化により得られるX線光電子分光 (XPS) でも同様の化学シフトが現れる。XPSの終状態は試料外の真空中であるため、EELSの場合のようなコアホール相互作用による終状態のシフトは関与しないので、スペクトルの解釈はEELSに比べて容易である。
(執筆 京都大学 倉田 博基教授)
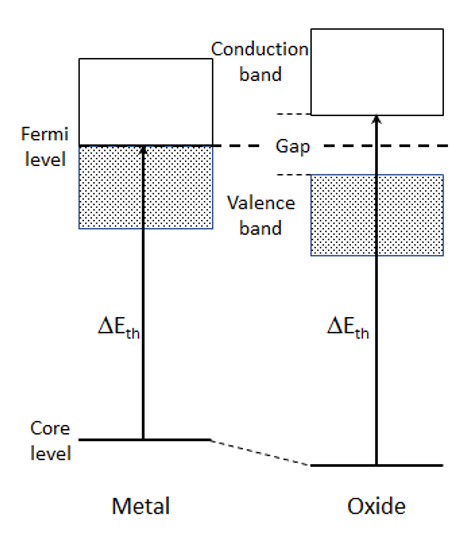
図1 基底状態における金属とその酸化物の内殻電子励起スペクトルの閾エネルギー
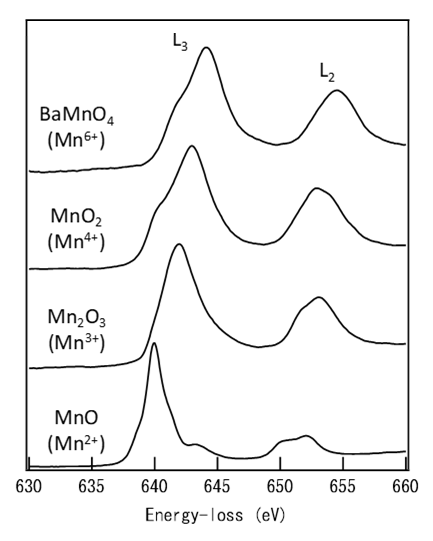
図2 種々のマンガン酸化物のL2,3殻電子励起スペクトル
マンガンの価数が高くなるほどL2,3吸収端が高エネルギー側にシフトしている。
Chemical shift means the change of the onset energy (threshold energy) of a core-loss spectrum obtained by Electron Energy-Loss Spectroscopy (EELS), which depends on the bonding states and the valence number of an excited atom (chemical environment).
The threshold energy is determined by the energy difference between the core level (initial state) and the lowest energy level in the unoccupied band (the final state). The energies of the initial and final states change with the chemical environment.
As an example, consider the case of the core-electron excitation spectrum of a metal atom in a metal and its oxide (Fig. 1). In the case of the metal, the spectral threshold energy is given by the energy difference between the core level, from which an electron is excited, and the level just above the Fermi level. In the case of a metal-oxide, the valence electron density on the metal atom decreases because electrons move from the metal atom to the oxygen due to the metal-oxygen bonding. As a result, the electrostatic potential energy of the inner shell electrons due to the nucleus increases (the screening of the nuclear potential with the valence electrons decreases), leading to a shift of the core level (initial state) to the low energy side. Thus, the energy difference between the initial state and the final state becomes large, and the threshold energy shifts to the high energy side. Among the different oxides of the same metal, as the valence number of the metal ion is higher, the shift of the core level to the low energy side tends to be larger. In addition, for the insulating oxide, as an energy gap appears near the Fermi level, the bottom energy of the unoccupied band (final state) shifts to the high energy side. Therefore, the threshold energy of the oxide becomes larger than that of the metal, giving a positive chemical shift (shift to the high energy side). Fig. 2 shows examples of chemical shift appearing in the EELS spectra of manganese obtained from various manganese oxides. The spectra elucidate that, as the valence number of manganese is larger, the spectral peak is seen to shift by a few eV to the high energy side.
The above description assumes that the transition of the electron occurs from the ground state where the core electron is not excited. However, in real experiments, the influence of the core hole, which is created by the excitation of the core electron, should be taken into account. The core hole gives rise to an attraction-type Coulomb potential and the electrons near the core hole are attracted to the core hole to screen the Coulomb potential. This can lead to the shift of the core level to the high energy side, but this effect is regarded to be small.
For the insulating material, it is known that the core hole and the excited electrons often form a bound state (core exciton). The exciton level that appears in the band gap may become the final state for EELS. In such a case, the threshold energy decreases by the energy value of the binding energy of the exciton. The binding energy of the core exciton depends on materials, but ranging from about 100 meV to beyond 1 eV. When the binding energy of the core exciton is large, a spectral peak is observed as a separate peak just below the absorption edge. Since the chemical shift measured by EELS is affected also by the change in the final state, the interpretation of the EELS spectra is not easy. If the spectra of standard materials can be obtained in advance, it is possible to use the chemical shift to determine the valence number.
It should be noted that X-ray Photoelectron Spectroscopy (XPS) provides also information on chemical shift arising at ionization of a core electron. The final state of XPS exists in vacuum outside the specimen. Thus, the final state always stays the same and does not contribute to the chemical shift in XPS, this situation being different from the case of the core-hole interaction in EELS. Therefore, the spectral interpretation of chemical shift by XPS is easier than that by EELS.
(By Professor Hiroki Kurata, Kyoto University)

Fig. 1
Threshold energies of a core-loss spectrum obtained from metal at the ground state and from its oxide.

Fig. 2
L2,3-shell excitation spectra of various manganese oxides. As the valence number of manganese is higher, an L2,3-absorption edge shifts to the high energy side.
関連用語から探す
説明に「化学シフト」が含まれている用語






